题目内容
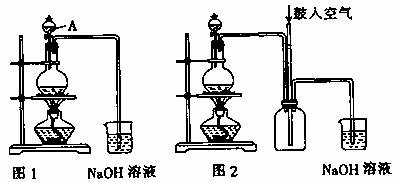
0.5mol·L-1的一元酸A和未知浓度的一元强碱B以1∶2的体积比混合,所得溶液中[OH-]=0.1mol·L-1,用B中和20mL[H+]为0.01mol·L-1的一元弱酸C,当恰好完全反应时,用去5mL B溶液,求弱酸C的电离度.(电离度是指弱电解质达到电离平衡时,已电离的电解质分子数占原电解质分子数的百分数)
答案:
解析:
解析:
|
解:设B的物质的量浓度为a,弱酸C的物质的量浓度为b,则: 又由:0.4×5=20×b,解得b=0.1mol·L-1; 由电离度的概念知: α= |

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
酸性高锰酸钾溶液能将醇氧化成一系列产物,反应中KMnO4被还原为Mn2+。用0.5mol·L-1的酸性高锰酸钾溶液滴定20.0mL0.25mol·L-1的乙二醇溶液,当用去20.0mL高锰酸钾溶液时,再加一滴高锰酸钾溶液恰好呈紫色,振荡后不褪色。则乙二醇被氧化为
| A.HOCH2-CHO | B.OHC-CHO | C.HOOC-CHO | D.CO2 |
 =0.1,解得a=0.4mol·L-1;
=0.1,解得a=0.4mol·L-1;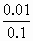 ×100%=10%,即弱酸C的电离度为10%.
×100%=10%,即弱酸C的电离度为10%.