题目内容
(11分)氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是_____________________________________________________________________________。
(2)根据表中数据,在500℃合成氨反应达到平衡时,与反应前的体积相比,反应后体积缩小的百分率是____________(保留2位有效数字)。
(3)在一定温度下,将2 mol N2和6 mol H2通入到体积为2 L的密闭容器中,发生反应
N2+3H2 2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。
2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是______(选填序号字母)
a.及时分离出NH3 b.升高温度c.增大压强 d.使用催化剂
(5)NH3也能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为_______。
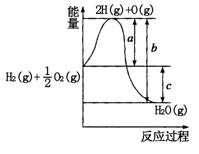
(6)根据下图的能量变化,求下列反应的反应热。

N2(g)+3H2(g) 2NH3(l) △H=___________。
2NH3(l) △H=___________。
| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13. 8 8 |
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是_____________________________________________________________________________。
(2)根据表中数据,在500℃合成氨反应达到平衡时,与反应前的体积相比,反应后体积缩小的百分率是____________(保留2位有效数字)。
(3)在一定温度下,将2 mol N2和6 mol H2通入到体积为2 L的密闭容器中,发生反应
N2+3H2
 2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。
2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是______(选填序号字母)
a.及时分离出NH3 b.升高温度c.增大压强 d.使用催化剂
(5)NH3也能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为_______。
(6)根据下图的能量变化,求下列反应的反应热。

N2(g)+3H2(g)
 2NH3(l) △H=___________。
2NH3(l) △H=___________。
略

练习册系列答案
相关题目
 2HI(g),
2HI(g), CH3OH(g)
CH3OH(g) H1
H1 .2mol·L-1,则CO的转化率为 ,此时的温度
.2mol·L-1,则CO的转化率为 ,此时的温度 CH4(g)+3/2O2(g)
CH4(g)+3/2O2(g) l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)
l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)  T1℃时催化效率最高,能使正反应速率加快约3×105倍;
T1℃时催化效率最高,能使正反应速率加快约3×105倍;
 目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下: