题目内容
3.在反应2F2+2H2O=4HF+O2中,H2O作还原剂,氧元素被氧化;在反应Ca+2H2O=Ca(OH)2+H2↑中,H2O作氧化剂,氢元素被还原.若在两个反应中,电子转移的物质的量相等时,产生氢气和氧气的质量比为1:8.分析 含元素的化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,根据化合价的变化计算转移的电子数.
解答 解:2F2+2H2O=4HF+O2中O元素的化合价由-2价升至0价,失去电子,被氧化,水作还原剂;
Ca+2H2O=Ca(OH)2+H2↑中,钙失电子,水中的氢化合价由+1价降到0价,被还原,水做氧化剂.
两反应的电子转移数分别为4和2,假设均转移了4 mol电子,前者生成1mol氧气,后者生成2mol氢气,两气体的质量比为32:4=8:1;
故答案为:H2O;氧; H2O;氢;1:8.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
13.用含有少量银和锌的粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液,电解一段时间后,阳极的质量减少了xg,则( )
| A. | 电解液的质量增加xg | B. | 阴极质量增加xg | ||
| C. | 阴极质量增加bg,b>x | D. | 阴极质量增加bg,b<x |
14.CuI是一种白色不溶于水的固体,以石墨(阴)和铜(阳)为电极组成电解槽,以含酚酞和淀粉的KI水溶液为电解液进行电解.电解开始不久,阴极区溶液显红色,而阳极区仍为无色.过了相当长的时间后,阳极区才呈蓝色,则电解开始时的电极反应为( )
| A. | 阳极反应:Cu-2e-═Cu2+ | B. | 阳极反应:2Cu-2e-+2I-═2CuI | ||
| C. | 阴极反应:Cu2++2e-═Cu | D. | 阴极反应:2H++2e-═H2↑ |
8.小明不小心将食用油混进了自来水,请你帮他选择下列何种最简便的方法进行分离.( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 萃取 |
15.已知某溶液中存在较多的H+、SO42-,则该溶液中还可以大量共存的离子组是( )
| A. | Al3+、CO32-、Cl- | B. | Mg2+、Ba2+、Br- | C. | Mg2+、Cl-、HCO3- | D. | Na+、NH4+、Cl- |
13.T℃时,将5mol A和7mol B气体通入体积为10L的密闭容器中(容积不变),反应过程中A、B、C浓度变化如图1所示.若保持其他条件不变,温度分别为T1和T2时,B 的体积分数与时间的关系如图2所示:
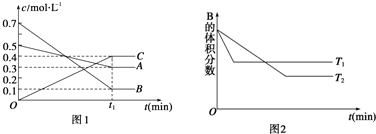
则下列结论正确的是( )

则下列结论正确的是( )
| A. | T℃时,将4 mol A,4 mol B和2 mol C气体通入体积为10 L的密闭容器中(容积不变),达到平衡时,C的浓度为0.4 mol•L-1 | |
| B. | 保持其他条件不变,在(t1+10)min时,加入催化剂,平衡向正反应方向移动 | |
| C. | 保持其他条件不变,在(t1+10)min时,通入稀有气体,平衡向逆反应方向移动 | |
| D. | 保持其他条件不变,升高温度,正、逆反应速率均增大,A的转化率也增大 |
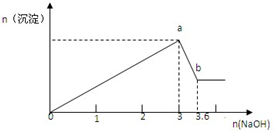 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出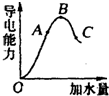 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答: