题目内容
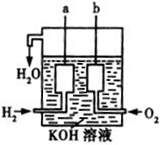
燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。
(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:
②已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-="=" CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
③随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
①该电池反应的总离子方程式为____________________________
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变)。
(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:
②已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-="=" CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
③随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
①该电池反应的总离子方程式为____________________________
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变)。
(11分)(1)①CH4+O2 CO2+2H2O (2分) ;
CO2+2H2O (2分) ;
②负极 (1分); 2O2+4H2O+8e-==8OH- (2分)
③减小 (1分) ; ④大于(1分)
(2)①2CH3OH+3O2+4OH-=2CO32-+6H2O (2分);
②负 (1分); 下降(1分)
 CO2+2H2O (2分) ;
CO2+2H2O (2分) ; ②负极 (1分); 2O2+4H2O+8e-==8OH- (2分)
③减小 (1分) ; ④大于(1分)
(2)①2CH3OH+3O2+4OH-=2CO32-+6H2O (2分);
②负 (1分); 下降(1分)
试题分析:(1)①甲烷与氧气反应生成二氧化钛和水,故方程式为CH4+O2
 CO2+2H2O。
CO2+2H2O。②CH4失去电子,发生氧化反应,是负极,O2是正极,得到电子,发生还原反应,电极反应式为2O2+4H2O+8e-==8OH-。
③根据反应式可知,KOH发生反应,故电解质溶液的碱性减小。
④甲烷燃烧会浪费大量的能量,故甲烷燃料电池的能量利用率大于甲烷燃烧的能量利用率。
(2)①根据题中给出的反应物和生成物,该电池反应的总离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O。
②甲醇失去电子,化学价升高,发生氧化反应,故甲醇在负极发生反应。强碱参与了反应,故电池在放电过程中溶液的pH将降低。
点评:本题考查的是燃料电池和新型电源的相关知识,题目难度大,熟悉原电池的工作原理是解题的关键,注意基础知识的学习、掌握及应用。

练习册系列答案
相关题目