题目内容
某元素一种同位素的原子质子数为m,中子数为n,则下列说法正确的是
[ ]
A.不能由此确定该元素的原子量
B.这种元素的原子量为(m+n)
C.若碳原子质量为Wg,此原子的质量为(m+n)Wg
D.核内中子的总质量小于质子的总质量
答案:A
解析:
解析:
|
元素的相对原子质量等于各同位素相对原子质量与该同位素在自然界中的原子百分含量的乘积之和.即

如 Ar(Cl)=34.969×75.77%+36.966×24.23%=35.45根据题目信息,已知某元素的一种同位素原子的质子数和中子数,只能确定该同位素的质量数,而不能确定这种元素的原子量.则 A的叙述正确,B的说法是错误的.国际上一致同意以碳 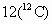 原子质量的1/12(约 原子质量的1/12(约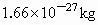 作为标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量,即原子量.根据有关概念可推知C、D的叙述都是错误的. 作为标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量,即原子量.根据有关概念可推知C、D的叙述都是错误的. |

练习册系列答案
相关题目
 ,用X射线研究其固体表明,在边长为1.00×
,用X射线研究其固体表明,在边长为1.00× 的立方体中含有20个原子.R在化学反应中常表现为+2价、+4价.在溶液中
的立方体中含有20个原子.R在化学反应中常表现为+2价、+4价.在溶液中 稳定,而
稳定,而 有强氧化性,可将NO氧化为
有强氧化性,可将NO氧化为 .氧化物
.氧化物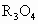 ,其性质与
,其性质与 有些类似.R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿环境中易形成铁锈.R的单质及化合物在工农业生产、医疗卫生、科学技术等各个领域都有很多用途.
有些类似.R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿环境中易形成铁锈.R的单质及化合物在工农业生产、医疗卫生、科学技术等各个领域都有很多用途. 溶液中,是否会发生反应?
溶液中,是否会发生反应? 反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为________.
反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为________.