题目内容
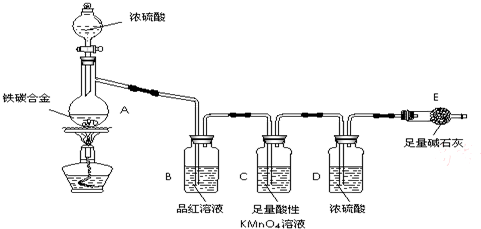
下图所示的实验装置(铁架台均略去)图中:A是简易的氢气发生器;B是大小适宜的圆底烧瓶;C是装有干燥剂的U形管;a是旋转活塞;D是装有还原铁粉的反应管;E是装有酚酞试液的烧杯。实验前先检查装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量的盐酸(浓度适当),产生氢气。经必要的操作[见问题(2)]后,在导管的出口处点燃氢气,然后如图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入烧杯E中,使酚酞试液呈红色。请回答下列有关问题。
(1)实验前如何检验装置的气密性?
答:_________________________________________________________________。
(2)点燃氢气前必须进行_____________操作,该操作方法是____________________________。
(3)写出B、D中分别发生反应的化学方程式。B中____________________,D中________________。
(4)C中所盛干燥剂的名称是___________,该干燥剂的作用是___________________________。
解析:审题时首先应注意到进入E中的气体能使酚酞试液变红,说明经过反应管D出来的气体是碱性的,初步判断该气体是NH3。在A中锌与盐酸反应产生H2,现在的关键是N2从哪里获得?应当注意到烧瓶B的作用。H2在B中燃烧到熄灭,实际是消耗掉容器里空气中的O2,再结合空气的组成,就容易判断出从B中导出的气体主要是H2和N2,还有少量水蒸气及H2产生时带出的少量酸雾。这样,在判断C中选用什么干燥剂及干燥剂的作用时,就知道必须要选择碱性的固体干燥剂,目的是除去水蒸气和盐酸酸雾,否则会影响氨的生成。
答案:(1)在A中放入少量水,使水面刚浸没漏斗颈下端,打开旋塞a,在烧瓶B底部稍加热,若在A中漏斗颈内水面上升,且E中导管口有气泡逸出,表示装置不漏气(也可以关闭活塞a,用同样的方法分别在烧瓶B底部和反应管D下部稍加热,检查活塞前、后两部分装置是否漏气)
(2)检验氢气纯度 用排水法(或向下排气法)收集一试管氢气,用拇指堵住,移近火焰,没有尖锐的爆鸣声,表示氢气纯度合格,可以点燃和收集
(3)2H2+O2![]() 2H2O N2+3H2
2H2O N2+3H2![]() 2NH3
2NH3
(4)碱石灰 吸收气体中少量水蒸气和盐酸酸雾