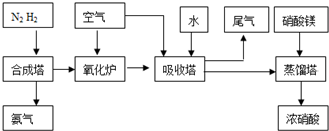
��Ŀ����
��ҵβ���е�������ͨ�����ð������շ�����ԭ����NH3��NOx�ڴ��������·�Ӧ�����������ʡ�ijУ�С��ͬѧ��������װ�úͲ���ģ�ҵ�ϵ�������Ĵ������̡�

I��̽����ȡNH3�ķ���
��1��������װ���У�H�ܿ��١������ȡNH3��װ������Ҫ���ӵķ�Ӧ�Լ�Ϊ ��
��2��Ϊ̽�����õ�ʵ��Ч�����С��ͬѧ��������Cװ������ȡ�������ڿ���ʵ��������ͬ������£�����±���ʵ�����ݡ�
|
�Լ������� |
�����Լ� |
NH3�����mL�� |
|
|
a |
6.0 g Ca(OH)2�������� |
5.4 g NH4Cl |
1344 |
|
b |
5.4g (NH4)2SO4 |
1364 |
|
|
c |
6.0 g NaOH�������� |
5.4 g NH4Cl |
1568 |
|
d |
5.4g (NH4)2SO4 |
1559 |
|
|
e |
6.0 g CaO�������� |
5.4 g NH4Cl |
1753 |
|
f |
5.4 g (NH4)2SO4 |
1792 |
�����������ݣ�����Ϊ���ַ�����ȡ������Ч����� ������ţ����Ӹ÷���ѡ���ԭ�Ϸ�������Ч���õĿ���ԭ���� ��
II��ģ��β������
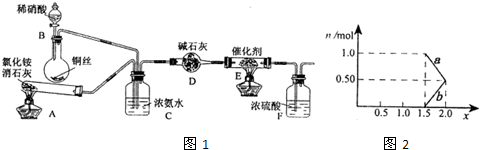
�С��ͬѧѡ����������װ�ã�������˳�����ӳ�ģ��β������װ�ý���ʵ�顣
��1���������װ����ѡ������Ϊ�����Ľ��в��䣨��ѡװ�ò����ظ�����

��2��A�з�Ӧ�����ӷ���ʽΪ ��
��3��Dװ�õ������У�ʹ�����Ͼ��ȡ����������ٶȡ� ��
��4��Dװ���е�Һ�廹�ɻ��� ������ţ���
a��H2O b��CCl4 c��ŨH2SO4 d��CuSO4��Һ
��5����С��ͬѧ����Ƶ�ģ��β������װ���л�����һ�����Ե�ȱ���� ��
I����1����ʯ����Ũ��ˮ�����ռ���Ũ��ˮ�� ����ѧʽ���֣���2�֣�
��2��f ��2�֣� (NH4)2SO4���Ȳ��ֽ⣬CaO������ˮ���ã������𰸾����֣���2�֣�
II����1��F E B ��2�֣�
��2��3Cu + 2NO3��+8H�� 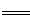 3Cu2�� + 2NO�� +4H2O ��2�֣�
3Cu2�� + 2NO�� +4H2O ��2�֣�
��3����ֹ�����ܽ⣨���ֹ��������2�֣�
��4��b��2�֣�
��5��δ��Ӧ��NO������������Ⱦ���� ��2�֣�
��������
�����������1������װ�÷����Ʊ���������������Һ��ͨ����Һ©��������ƿ�в����Ƚ��еķ�Ӧ��ʵ��Ŀ������ȡ��������ռ�������װ�ã��Ʊ������ȸ������ռ��������ȿ����ᣬӦ�������������ռ����Ʊ�������������Ũ��ˮ���������ƻ�����������ƻ��ʯ�ң��ܽ����ʱһˮ�ϰ��ֽ����ɰ�����
��2����ΪNH4Cl�����ֽ⣬���ɵIJ���NH3��HCl�����½�ϳ�NH4Cl������NaOH��Ca(OH)2����Ӧ�������ˮ�϶࣬���յ�NH3�϶࣬�ɱ������ݿ��Կ�����f��NH3������ߣ�
II����1���������������뷴Ӧװ�ã�Ȼ����Ũ��������û�з�Ӧ�İ�����
��2��ϡ�������ǿ�����ԣ���ͭ����������ԭ��Ӧ��������ͭ��NO�ȣ���Ӧ�����ӷ���ʽΪ3Cu
+ 2NO3��+8H��  3Cu2�� + 2NO�� +4H2O��
3Cu2�� + 2NO�� +4H2O��
��3��Dװ��ʹ�����Ͼ��ȡ����������ٶȣ����⣬���������ڱ��Ͱ�ˮ���ɷ�ֹ������
��4����������������ͭ��Һ��ˮ�Լ������У��ɲ�������������Ϊ���Է��ӣ������ڷǼ����ܼ�������CCl4���汥�Ͱ�ˮ��
��5��ȱ��β������װ�ã�������NO����Ⱦ������
���㣺���鵪��������������Լ��Ի�����Ӱ�졣

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д�| ���� | ��Ⱦָ�� | ��Ҫ��Ⱦ�� | ���������ȼ� | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | �� |
| B | 47 | 29 | 35 | SO2 | �� |
| C | 62 | 40 | 113 | PM10 | �� |
| D | 42 | 76 | 59 | NO2 | �� |
��2������β�����dz��д����е����������Ҫ��Դ֮һ����������֮һ���������������ϼ�װ����ת��������ʹCO��NOx��Ӧ���ɿɲ��������̬����ѭ���������壬��Щ��������
��3��SO2���ŷ�������������Ҫ���أ�
����������������������Һ���պ���������Ĺ�ҵ������д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ
�������������������ͨ�백ˮ�У��ܷ��������Ӧ������SO2���ŷ�������д�����п��ܷ�����һ��������ԭ��Ӧ�Ļ�ѧ����ʽ
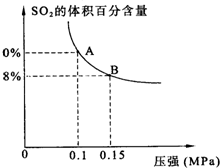 ��������͵��������dz��õĻ���ԭ�ϣ�Ҳ�����������������Ⱦ���ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��������͵��������dz��õĻ���ԭ�ϣ�Ҳ�����������������Ⱦ���ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��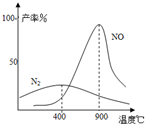 ��2009?��ɽģ�⣩��ҵ�ϳɰ����Ʊ�����һ��������������������£�
��2009?��ɽģ�⣩��ҵ�ϳɰ����Ʊ�����һ��������������������£�