题目内容
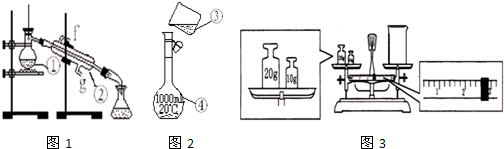
(6分)某同学欲配制250 mL 2 mol·L-1的碳酸钠溶液,并进行有关实验。请回答下列问题:
(1)需称量无水碳酸钠的质量 g。
(2)配制该碳酸钠溶液时使用的仪器除天平(带砝码)、烧杯、玻璃棒外,还必须用到的仪器有 、 等。
(3)取所配制的碳酸钠溶液125 mL,向其加入125 mL 3mol·L-1的硫酸溶液,待充分反应后,生成的气体在标准状况下所占的体积为(假设产生的气体全部逸出) ;设反应后溶液的体积为250mL,则反应后溶液中Na+的物质的量浓度为 。
(1)5.3 (2)容量瓶(250mL)、胶头滴管 (3)5.6L、2 mol·L-1
解析试题分析:(1)n(Na2CO3)=0.025L×2mol/L=0.05mol,m(Na2CO3)= 0.05mol×106g/mol=5.3g。
(2)配制溶液除使用天平(带砝码)、烧杯、玻璃棒外,还必须用到的仪器有250mL容量瓶和胶头滴管。
(3)根据Na2CO3+H2SO4=Na2SO4+CO2+H2O反应可知,硫酸过量,所以产生气体的体积由Na2CO3的量决定。设产生CO2 xmol
Na2CO3+H2SO4=Na2SO4+CO2+H2O
1 1
0.125×2 x
则x=0.25mol,体积为0.25mol×22.4mol/L=5.6L。
根据Na+守恒,可知溶液中有Na+0.5mol,所以c(Na+)=
考点:物质的量浓度计算
点评:本题基础简单

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目