题目内容
在一个不传热的固定容积的密闭容器中发生可逆反应:
mA(g) + nB(g) 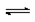 pC(g) + qD(g),当m.n.p.q为任意整数(不为零)时,不能说明达到平衡状态的标志是
pC(g) + qD(g),当m.n.p.q为任意整数(不为零)时,不能说明达到平衡状态的标志是
A.体系的压强不再改变
B.各组分的浓度不再改变
C.反应速率υA : υB : υC : υD =" m" : n : p : q
D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应
AC
【解析】
试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B可以说明;由于反应前后气体的体积可能是不变的,因此体系的压强也可能是不变的,A不能说明;速率之比是相应的化学计量数之比,因此C中的关系始终是成立,不能说明;D中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明,所以正确的大阿阿香AC。
考点:考查化学平衡状态的判断
点评:本题是高考中的常见题型,为中等难度的试题。该题难易适中,有利于巩固学生的基础知识,更有利于培养学生的答题能力,提高学习效率。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(9分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如
下图:
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是_______________ (填“吸”、“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与HzO均为1 mo1,则达到平衡后CO的转化率为_____。
(2)此流程的第II步反应CO(g)+H2O(g) H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是
① 体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④ 各组分的物质的量浓度不再改变 ⑤ 体系的温度不再发生变化 ⑥ v(CO2正)= v(H2O逆)
(4) 图表示该反应此流程的第II步反应在时刻t![]() 达到平衡、在时刻t
达到平衡、在时刻t![]() 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t![]() 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)
(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值为 33.2(单位为kJ),第Ⅰ步反应的热化学方程式为: CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
(9分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如
下图:
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
从上表可以推断:此反应是_______________ (填“吸”、“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与HzO均为1 mo1,则达到平衡后CO的转化率为_____。
(2)此流程的第II步反应CO(g)+H2O(g)
 H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥ v(CO2正)= v(H2O逆)
(4)图表示该反应此流程的第II步反应在时刻t
 达到平衡、在时刻t
达到平衡、在时刻t 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)
(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值为 33.2(单位为kJ),第Ⅰ步反应的热化学方程式为: CH4(g)+H2O(g)=3H2(g)+CO(g)△H="-103.3" kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
(10分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如右图:

(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;反应的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
|
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1mo1,则达到平衡后CO的转化率为 。
(2)在830℃,以下表的物质的量(单位为mol)投入恒容反应器发生上述第II步反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
|
实验编号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
0.5 |
2 |
1 |
1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
(4)右图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是(写出两种) 。

(9分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如
下图:

(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一,
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
从上表可以推断:此反应是_______________ (填“吸”、“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与HzO均为1 mo1,则达到平衡后CO的转化率为_____。
(2)此流程的第II步反应CO(g)+H2O(g) H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
|
实验编号 |
N(CO) |
N(H2O) |
n(H2) |
N(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
0.5 |
2 |
1 |
1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是
① 体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④ 各组分的物质的量浓度不再改变 ⑤ 体系的温度不再发生变化 ⑥ v(CO2正)= v(H2O逆)
(4) 图表示该反应此流程的第II步反应在时刻t 达到平衡、在时刻t
达到平衡、在时刻t 分别因改变某个条件而发生变化的情况:图中时刻t
分别因改变某个条件而发生变化的情况:图中时刻t 发生改变的条件是_________。(写出两种)
发生改变的条件是_________。(写出两种)

(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值为 33.2(单位为kJ),第Ⅰ步反应的热化学方程式为: CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1: