题目内容
(1)醋酸可用于除去水壶中的水垢,成份主要是CaCO3和Mg(OH)2.写出醋酸与Mg(OH)2反应的离子方程式 .(2)将11.2L(标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液质量增加了8.4克,则原混合气体中烯和乙烷的质量之比为:
(3)在2L密闭容器中,一定条件下发生反应A(g)+3B (g)
 2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为 .
2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为 .
【答案】分析:(1)根据醋酸具有酸的通性,能和碱反应生成盐和水;
(2)乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量.根据n=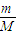 =
=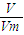 计算物质的量、质量关系;
计算物质的量、质量关系;
(3)先求出A的平均反应速率,再根据同一反应,不同物质反应速率速率之比等于计量数之比,求出C的平均反应速率.
解答:解:(1)因CHCOOH能和Mg(OH)2,生成(CH3COO)2Mg和水,化学方程式为:2CHCOOH+Mg(OH)2═(CH3COO)2Mg+2H2O,故答案为:Mg(OH)2+2CHCOOH=2CH3COO-+Mg2++2H2O,
(2)11.2L混合气体的物质的量为n=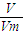 =
=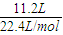 =0.5mol,乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,所以乙烯的物质的量为n=
=0.5mol,乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,所以乙烯的物质的量为n=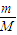 =
=
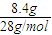 =0.3mol,则乙烷的物质的量为:0.5mol-0.3mol=0.2mol,质量为:0.2mol×30g/mol=6g,所以,乙烯与乙烷的质量之比为8.4g:6g=7:5,故答案为:7:5,
=0.3mol,则乙烷的物质的量为:0.5mol-0.3mol=0.2mol,质量为:0.2mol×30g/mol=6g,所以,乙烯与乙烷的质量之比为8.4g:6g=7:5,故答案为:7:5,
(3)在10秒内v(A)= =
= =0.04mol?L-1?s-1,而同一反应,不同物质反应速率速率之比等于计量数之比,所以v(C)=2 v(A)=2×0.04mol?L-1?s-1=0.08mol?L-1?s-1,故答案为:0.08mol/(L?s).
=0.04mol?L-1?s-1,而同一反应,不同物质反应速率速率之比等于计量数之比,所以v(C)=2 v(A)=2×0.04mol?L-1?s-1=0.08mol?L-1?s-1,故答案为:0.08mol/(L?s).
点评:本题问题(2)主要考查物质的量的相关计算,题目难度不大,注意乙烯与乙烷的性质差别是解题的关键.
(2)乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量.根据n=
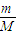 =
=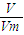 计算物质的量、质量关系;
计算物质的量、质量关系;(3)先求出A的平均反应速率,再根据同一反应,不同物质反应速率速率之比等于计量数之比,求出C的平均反应速率.
解答:解:(1)因CHCOOH能和Mg(OH)2,生成(CH3COO)2Mg和水,化学方程式为:2CHCOOH+Mg(OH)2═(CH3COO)2Mg+2H2O,故答案为:Mg(OH)2+2CHCOOH=2CH3COO-+Mg2++2H2O,
(2)11.2L混合气体的物质的量为n=
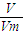 =
=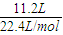 =0.5mol,乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,所以乙烯的物质的量为n=
=0.5mol,乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,所以乙烯的物质的量为n=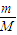 =
=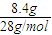 =0.3mol,则乙烷的物质的量为:0.5mol-0.3mol=0.2mol,质量为:0.2mol×30g/mol=6g,所以,乙烯与乙烷的质量之比为8.4g:6g=7:5,故答案为:7:5,
=0.3mol,则乙烷的物质的量为:0.5mol-0.3mol=0.2mol,质量为:0.2mol×30g/mol=6g,所以,乙烯与乙烷的质量之比为8.4g:6g=7:5,故答案为:7:5,(3)在10秒内v(A)=
 =
= =0.04mol?L-1?s-1,而同一反应,不同物质反应速率速率之比等于计量数之比,所以v(C)=2 v(A)=2×0.04mol?L-1?s-1=0.08mol?L-1?s-1,故答案为:0.08mol/(L?s).
=0.04mol?L-1?s-1,而同一反应,不同物质反应速率速率之比等于计量数之比,所以v(C)=2 v(A)=2×0.04mol?L-1?s-1=0.08mol?L-1?s-1,故答案为:0.08mol/(L?s).点评:本题问题(2)主要考查物质的量的相关计算,题目难度不大,注意乙烯与乙烷的性质差别是解题的关键.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
 2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为
2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为