题目内容
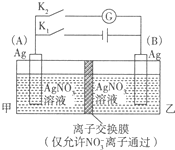
图为相互串联的甲、乙两电解池.试回答:
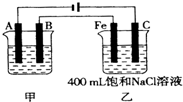
(1)若甲电解池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应式 ;B(要求同A)是 ,电极反应式 ;应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 ,C极附近呈 。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是 。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol?L-1,溶液的pH等于 。

(1)若甲电解池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应式 ;B(要求同A)是 ,电极反应式 ;应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 ,C极附近呈 。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是 。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol?L-1,溶液的pH等于 。
(1)铁、阴极,Ag++e-═Ag;银、阳极、Ag-e-═Ag+; 硝酸银溶液。
(2)红;浅黄绿
(3)448mL
(4)0.1mol/L;13
(2)红;浅黄绿
(3)448mL
(4)0.1mol/L;13
(1)甲池是电镀池,铁作阴极,银作阳极,阴极上银离子得电子发生还原反应,电极反应式为Ag++e-═Ag,阳极上银失电子发生氧化反应,电极反应式为Ag-e-═Ag+,电解质溶液为可溶性的硝酸银溶液。
(2)乙是电解池,碳电极上氯离子放电生成氯气,铁电极上氢离子放电生成氢气,同时溶液中生成氢氧根离子,导致铁电极附近溶液呈碱性,酚酞试剂遇碱变红色,所以铁电极附近溶液变红色,碳电极上生成氯气,氯气是浅黄绿色气体,溶于水而使溶液呈浅黄绿色,所以C电极附近呈浅黄绿色。
(3)甲池中阴极上析出银,若甲电解池阴极增重4.32g,转移电子的物质的量=4.32g÷108g/mol=0.04mol,乙池中阳极上生成氯气,生成1mol氯气转移电子的物质的量是2mol,当转移0.04mol电子时生成氯气的物质的量为0.02mol,则氧气体积=0.02mol×22.4L/mol=0.224L=448mL。
(4)乙池中电池反应式为2NaCl+2H2O H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.02mol氯气时同时生成0.04mol氢氧化钠,则氢氧化钠的物质的量浓度=0.04mol÷0.4L=0.1mol/L,则溶液中氢离子浓度=10?14/0.1
H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.02mol氯气时同时生成0.04mol氢氧化钠,则氢氧化钠的物质的量浓度=0.04mol÷0.4L=0.1mol/L,则溶液中氢离子浓度=10?14/0.1
mol/L=10-13 mol/L,所以其pH=13。
(2)乙是电解池,碳电极上氯离子放电生成氯气,铁电极上氢离子放电生成氢气,同时溶液中生成氢氧根离子,导致铁电极附近溶液呈碱性,酚酞试剂遇碱变红色,所以铁电极附近溶液变红色,碳电极上生成氯气,氯气是浅黄绿色气体,溶于水而使溶液呈浅黄绿色,所以C电极附近呈浅黄绿色。
(3)甲池中阴极上析出银,若甲电解池阴极增重4.32g,转移电子的物质的量=4.32g÷108g/mol=0.04mol,乙池中阳极上生成氯气,生成1mol氯气转移电子的物质的量是2mol,当转移0.04mol电子时生成氯气的物质的量为0.02mol,则氧气体积=0.02mol×22.4L/mol=0.224L=448mL。
(4)乙池中电池反应式为2NaCl+2H2O
 H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.02mol氯气时同时生成0.04mol氢氧化钠,则氢氧化钠的物质的量浓度=0.04mol÷0.4L=0.1mol/L,则溶液中氢离子浓度=10?14/0.1
H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.02mol氯气时同时生成0.04mol氢氧化钠,则氢氧化钠的物质的量浓度=0.04mol÷0.4L=0.1mol/L,则溶液中氢离子浓度=10?14/0.1mol/L=10-13 mol/L,所以其pH=13。

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。 


 4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融 氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是
4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融 氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是