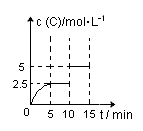题目内容
 一定温度下有可逆反应:A(g)+2B(g)?2C(g)+D(g).现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是( )
一定温度下有可逆反应:A(g)+2B(g)?2C(g)+D(g).现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是( )| A、在0~5min内,正反应速率逐渐增大 | B、反应从起始至5min时,B的转化率为50% | C、5min时的平衡常数与10min时的平衡常数不等 | D、第15min时,B的体积分数为25% |
分析:A、根据图象可知,0~5min内C的物质的量浓度在增大,说明反应还在正向进行,反应物的浓度正在减小,所以正反应速率在逐渐减小,据此判断;
B、根据C的物质的量浓度的变化,可以求得B的物质的量浓度的变化,进而求得B的转化率;
C、平衡常数只与温度有关,与其它物理量都无关,而本题温度没有变化,所以化平衡常数不变,据此判断;
D、根据图象可知,在10min~15min时,平衡没有移动,第15min时,B的体积分数和第10min时的一样,根据平衡时C的物质的量浓度可以求得B的物质的量的浓度,进而求得B的体积分数.
B、根据C的物质的量浓度的变化,可以求得B的物质的量浓度的变化,进而求得B的转化率;
C、平衡常数只与温度有关,与其它物理量都无关,而本题温度没有变化,所以化平衡常数不变,据此判断;
D、根据图象可知,在10min~15min时,平衡没有移动,第15min时,B的体积分数和第10min时的一样,根据平衡时C的物质的量浓度可以求得B的物质的量的浓度,进而求得B的体积分数.
解答:解:A、根据图象可知,0~5min内C的物质的量浓度在增大,说明反应还在正向进行,反应物的浓度正在减小,所以正反应速率在逐渐减小,故A错误;
B、5mol A和10mol B加入一体积为2L的密闭容器中,得c(A)=2.5mol/L,c(B)=5mol/L,
A(g)+2B(g)?2C(g)+D(g).
起始浓度(mol/L) 2.5 5 0
反应变化的浓度(mol/L) 1.25 2.5 2.5
平衡时的浓度(mol/L) c平(A)c平(B) 2.5
c平(B)=2.5mol/L
∴B的转化率α=
×100%=50%
故B正确;
C、平衡常数只与温度有关,与其它物理量都无关,而本题温度没有变化,所以化平衡常数不变,故C错误;
D、根据图象可知,在10min~15min时,平衡没有移动,第15min时,B的体积分数和第10min时的一样,
在第10min时,
A(g)+2B(g)?2C(g)+D(g).
起始物质的量(mol) 5 10 0
反应变化的物质的量(mol) 2.5 5 5
平衡时的物质的量(mol) n(A) n(B) 2.5×2
∴平衡时n(A)=2.5mol n(B)=5mol n(C)=5mol
∴B的体积分数=
×100%=
×100%=40%,故D错误;
故选B
B、5mol A和10mol B加入一体积为2L的密闭容器中,得c(A)=2.5mol/L,c(B)=5mol/L,
A(g)+2B(g)?2C(g)+D(g).
起始浓度(mol/L) 2.5 5 0
反应变化的浓度(mol/L) 1.25 2.5 2.5
平衡时的浓度(mol/L) c平(A)c平(B) 2.5
c平(B)=2.5mol/L
∴B的转化率α=
| 2.5mol/L |
| 5mol/L |
故B正确;
C、平衡常数只与温度有关,与其它物理量都无关,而本题温度没有变化,所以化平衡常数不变,故C错误;
D、根据图象可知,在10min~15min时,平衡没有移动,第15min时,B的体积分数和第10min时的一样,
在第10min时,
A(g)+2B(g)?2C(g)+D(g).
起始物质的量(mol) 5 10 0
反应变化的物质的量(mol) 2.5 5 5
平衡时的物质的量(mol) n(A) n(B) 2.5×2
∴平衡时n(A)=2.5mol n(B)=5mol n(C)=5mol
∴B的体积分数=
| n(B) |
| n(A)+ n(B)+n(C) |
| 5 |
| 2.5+5+5 |
故选B
点评:本题主要考查了化学平衡中转化率和体积分数的计算,难度中等,解题的关键在于读懂图象,要从图象中得知第10分钟时条件改变,平衡不移动,这是这个题目的难点.

练习册系列答案
相关题目
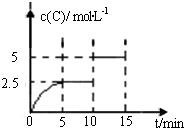
 一定温度下有可逆反应:A(g)+2B(g)?2C(g)+D(g).现将4molA和8molB加入一体积为2L的密闭容器中,反应至10min时,改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是( )
一定温度下有可逆反应:A(g)+2B(g)?2C(g)+D(g).现将4molA和8molB加入一体积为2L的密闭容器中,反应至10min时,改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是( )| A、在0~5min内,正反应速率逐渐增大 | B、反应从起始至8min时,A的转化率为50% | C、5min时的平衡常数与10min时的平衡常数不等 | D、第15min时,B的体积分数为25% |
一定温度下有可逆反应:A(g)+2B(g)  2C(g)+D(g) 。现将4 molA和8 molB加入一体积为2L的密闭容器中,反应至10min时,改变某一条件,C的物质的量浓度随时间变化关系如图所示。下列有关说法正确的是
2C(g)+D(g) 。现将4 molA和8 molB加入一体积为2L的密闭容器中,反应至10min时,改变某一条件,C的物质的量浓度随时间变化关系如图所示。下列有关说法正确的是 
| A.在0~5min内,正反应速率逐渐增大 |
| B.反应从起始至8min时,A的转化率为50% |
| C.第15min时,B的体积分数为25% |
| D.5min时的平衡常数与10min时的平衡常数不等 |
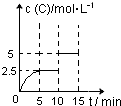
一定温度下有可逆反应:A(g)+2B(g)  2C(g)+D(g) 。现将4 molA和8 molB加入一体积为2L的密闭容器中,反应至10min时,改变某一条件,C的物质的量浓度随时间变化关系如图所示。下列有关说法正确的是
2C(g)+D(g) 。现将4 molA和8 molB加入一体积为2L的密闭容器中,反应至10min时,改变某一条件,C的物质的量浓度随时间变化关系如图所示。下列有关说法正确的是 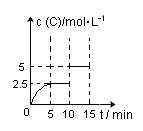
| A.在0~5min内,正反应速率逐渐增大 |
| B.反应从起始至8min时,A的转化率为50% |
| C.5min时的平衡常数与10min时的平衡常数不等 |
| D.第15min时,B的体积分数为25% |
 2C(g)+D(g) 。现将4 molA和8 molB加入一体积为2L的密闭容器中,反应至10min时,改变某一条件,C的物质的量浓度随时间变化关系如图所示。下列有关说法正确的是
2C(g)+D(g) 。现将4 molA和8 molB加入一体积为2L的密闭容器中,反应至10min时,改变某一条件,C的物质的量浓度随时间变化关系如图所示。下列有关说法正确的是