��Ŀ����
ij��������FeCl3��Һ��ʴ����ͭ�ľ�Ե��������·�壬һʵ��С��Ըó�������·�����õķ�Һ���з�����ȡ50��0 mL��Һ�������м���0��64 g Cu������ͭȫ���ܽ⡣��ȡ50��0 mL��Һ�������м���������AgNO3����������43��05 g������˵����ȷ���ǣ� ��
| A��ԭ��Һ�к��еĽ���������ֻ��Fe2����Cu2�� |
| B���ù���ԭ��ʹ�õ�FeCl3��Һ�����ʵ���Ũ��ԼΪ2 mol/L |
| C������500 mL��Һ�м���������ϡHNO3��Һ���ڱ���²���NO����4��48 L����ԭ��Һ��Fe2����Cu2�������ʵ���Ũ��֮��Ϊ2:1 |
| D������ʹ�����軯����Һ����÷�Һ���Ƿ���Fe2�� |
BC
����������������Ϣ��֪,ͭ��0��01molȫ���ܽ⣬Ӧ����0��02molFe3+��A���Եڶ�����Һ����,��֪������=�Ȼ���=43��05/(108+35��5)= 0��3mol ���ù���ԭ��ʹ�õ�FeCl3��Һ�����ʵ���Ũ��ԼΪC=0��1 mol /0��05 L ="2" mol/L��B��ȷ������500ml������0��2molNO,��ô��50ml��Ӧ�ÿ��Եõ�0��06mol���ӣ���0��06molӦ����Fe2+ ,��Һ��������0��02molFe3+, 0��06molFe2+ ,0��3mol Cl-������Ϊ�����Һ����Ӧ����FeCl3��Cu�ķ�Ӧ����,2Fe3+ +Cu=2Fe2+ +Cu2+���Fe2+=2Cu2+��0��03molCu �ɵ����غ�, 0��3-0��06��2-0��03��2=0��12,����Ӧ����0��04molFe3+������������,0��03mol CuCl2 ,0��06molFeCl2 ,0��04mol FeCl3����C����ȷ�ģ�Dֻʹ�����軯����Һ������÷�Һ���Ƿ���Fe2��������

��ϰ��ϵ�д�
 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�
�����Ŀ
 4NH3 (g)+3O2 (g) - Q �������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧ ��ѡ���ţ���
4NH3 (g)+3O2 (g) - Q �������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧ ��ѡ���ţ���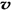 ��N2��/
��N2��/ 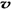 ��O2��=2:3
��O2��=2:3 6H2O��+ 2N2��+ 4HCl��+ 5O2�����������������뻹ԭ��������ʵ���֮���� ��ÿ�ֽ�1mol������泥�ת�Ƶĵ�����Ŀ�� ��
6H2O��+ 2N2��+ 4HCl��+ 5O2�����������������뻹ԭ��������ʵ���֮���� ��ÿ�ֽ�1mol������泥�ת�Ƶĵ�����Ŀ�� ��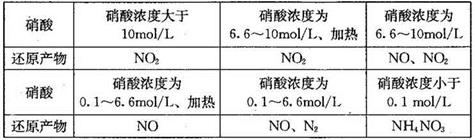


 KClO3 + 5KCl + 3H2O������˵����ȷ����
KClO3 + 5KCl + 3H2O������˵����ȷ����