题目内容
(16分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
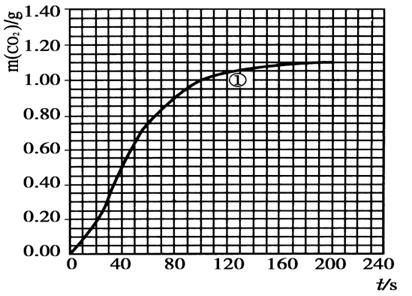
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式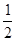 CaCO3+HNO3=
CaCO3+HNO3=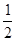 Ca(NO3)2+
Ca(NO3)2+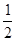 CO2↑+
CO2↑+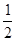 H2O,计算实验①在70~90 s范围内HNO3的平均反应速率为 。(可用分数表示)
H2O,计算实验①在70~90 s范围内HNO3的平均反应速率为 。(可用分数表示)
(3)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/K | 大理石 规格 | HNO3浓度(mol·L-1) | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;) |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
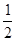 CaCO3+HNO3=
CaCO3+HNO3=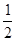 Ca(NO3)2+
Ca(NO3)2+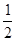 CO2↑+
CO2↑+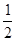 H2O,计算实验①在70~90 s范围内HNO3的平均反应速率为 。(可用分数表示)
H2O,计算实验①在70~90 s范围内HNO3的平均反应速率为 。(可用分数表示)(3)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。

(16分)(1)②:298;粗颗粒;1.00; ③:308;粗颗粒;2.00;
④:298;细颗粒;2.00
(Ⅱ)③(Ⅲ)④。(每空1分)
(2)v(HNO3)=△c(HNO3)/△t =" 1/110" mol·L-1·s-1(2分)
(3)如图:(3分)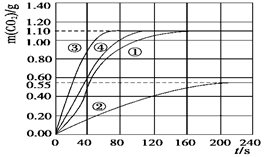
④:298;细颗粒;2.00
(Ⅱ)③(Ⅲ)④。(每空1分)
(2)v(HNO3)=△c(HNO3)/△t =" 1/110" mol·L-1·s-1(2分)
(3)如图:(3分)

(1)实验①和②探究HNO3浓度对该反应速率的影响,所以在实验②中改变的是硝酸的浓度,其余都是不变的,即硝酸的浓度是1.00mol/L;要探究温度对该反应速率的影响,则改变的条件就是稳定,即在实验③中温度是308℃,其余和实验①是相同的;要探究大理石规格(粗、细)对该反应速率的影响,则实验④中改变的应该是大理石的表面积,其余都是不变的。
(2)实验①在70~90 s范围内,生成CO2的质量是0.95g-0.85g=0.1g,所以根据方程式可知,消耗硝酸的物质的量是0.1/44×2mol,所以硝酸的反应速率是
 mol·L-1·s-1。
mol·L-1·s-1。
(3)考查外界条件对反应速率的影响。其它条件不变的情况下,参加反应的物质的浓度越大、或升高温度,或增大反应物的接触面积等均可以加快反应速率,所以正确的图像是(见答案)。
(2)实验①在70~90 s范围内,生成CO2的质量是0.95g-0.85g=0.1g,所以根据方程式可知,消耗硝酸的物质的量是0.1/44×2mol,所以硝酸的反应速率是
 mol·L-1·s-1。
mol·L-1·s-1。(3)考查外界条件对反应速率的影响。其它条件不变的情况下,参加反应的物质的浓度越大、或升高温度,或增大反应物的接触面积等均可以加快反应速率,所以正确的图像是(见答案)。

练习册系列答案
相关题目
 2C(g);△H<0,下列各图正确的是
2C(g);△H<0,下列各图正确的是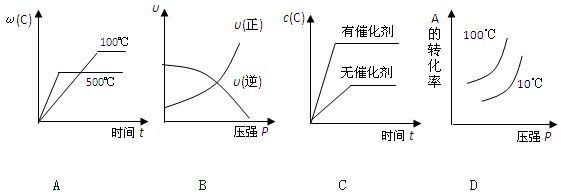
 2NO在密闭容器中进行,下列条件中哪些能加快该反应的反应速率(假定温度不变) ( )
2NO在密闭容器中进行,下列条件中哪些能加快该反应的反应速率(假定温度不变) ( )