题目内容
已知下列反应的平衡常数:①H2(g)+S(s) H2S(g) K1; ②S(s)+O2(g)
H2S(g) K1; ②S(s)+O2(g)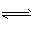 SO2(g) K2,
SO2(g) K2,
则反应③H2(g)+ SO2(g) O2(g)+ H2S(g)的平衡常数是
O2(g)+ H2S(g)的平衡常数是
 H2S(g) K1; ②S(s)+O2(g)
H2S(g) K1; ②S(s)+O2(g)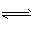 SO2(g) K2,
SO2(g) K2,则反应③H2(g)+ SO2(g)
 O2(g)+ H2S(g)的平衡常数是
O2(g)+ H2S(g)的平衡常数是[ ]
A. K1+K2
B. K1-K2
C. K1×K2
D.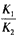
B. K1-K2
C. K1×K2
D.
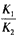
D

练习册系列答案
相关题目
(2012?松江区一模)已知某化学反应的平衡常数表达式为K=
|
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表(H+与OH-未列出):
根据表中数据判断PM2.5的酸碱性为 ,试样的PH值= .
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+
O2(g)=H2O(g)△H=-241.8kJ/mol C(s)+
O2(g)=CO(g)△H=-110.5kJ/mol,写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 .
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8mol N2和0.2mol O2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,计算该温度下的平衡常数的数值,并写出计算过程;
②汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 .
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据 .
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表(H+与OH-未列出):
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
②洗涤含SO2的烟气,以下物质可作洗涤剂的是
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8mol N2和0.2mol O2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,计算该温度下的平衡常数的数值,并写出计算过程;
②汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含离子的化学组分及其浓度如下表:
根据表中数据判断试样的pH= .
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+
O2(g)=H20 (g)△H=-241.8kJ?mol-1
C(s)+
O2(g)=CO (g)△H=-110.5kJ?mol-1
写出焦炭与水蒸气反应的热化学方程式: .
②洗涤含SO2的烟气.以下物质可作洗涤剂的是 .
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
①若1mol空气含0.8mol N2和0.2mol O2,汽缸中的化学反应式为N2(g)+O2(g)?2NO(g)△H>0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K= .汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 .
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 .
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H>0,判断该设想能否实现并简述其依据: .
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
写出焦炭与水蒸气反应的热化学方程式:
②洗涤含SO2的烟气.以下物质可作洗涤剂的是
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
①若1mol空气含0.8mol N2和0.2mol O2,汽缸中的化学反应式为N2(g)+O2(g)?2NO(g)△H>0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H>0,判断该设想能否实现并简述其依据:
 (2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
(2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):