题目内容
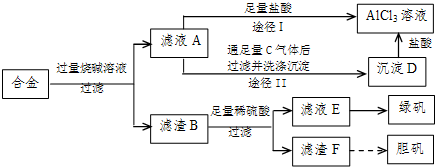
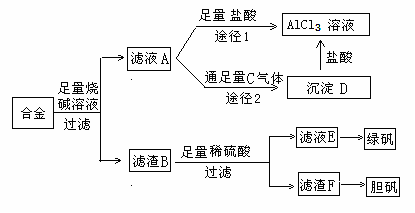
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如图:
试回答下列问题:
(1)写出滤液A转化为沉淀D的离子方程式______.
(2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径______(填“I”或“II”),理由是______.
(3)从滤液E中得到绿矾晶体的实验操作是(不考虑E中的溶质被氧化这一因素):______.
(4)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总的化学方程式为______.
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否合理?______.理由是______.
【答案】分析:(1)根据所发生的反应来确定溶液的组成情况,并书写发生的反应;
(2)根据反应所得产物的组成来选择合适的制取方案;
(3)根据溶液来得到晶体来分析实验操作;
(4)根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(5)根据实验中的酸和碱的量的情况来对比回答.
解答:解:(1)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,实质为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,
故答案为:Ⅱ;因为滤液A是偏铝酸钠和氢氧化钠溶液,按途径I直接向A中加入盐酸得到的AlCl3溶液中含有大量的氯化钠杂质;按途径II通入二氧化碳气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶;
(4)铜不能和稀硫酸反应,贴可以和硫酸反应,所以滤渣F是金属铜,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O,故答案为:Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O;
(5)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:不合理;因为该方案操作步骤多、时间长,消耗试剂量大.
点评:本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.
(2)根据反应所得产物的组成来选择合适的制取方案;
(3)根据溶液来得到晶体来分析实验操作;
(4)根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(5)根据实验中的酸和碱的量的情况来对比回答.
解答:解:(1)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,实质为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,
故答案为:Ⅱ;因为滤液A是偏铝酸钠和氢氧化钠溶液,按途径I直接向A中加入盐酸得到的AlCl3溶液中含有大量的氯化钠杂质;按途径II通入二氧化碳气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶;
(4)铜不能和稀硫酸反应,贴可以和硫酸反应,所以滤渣F是金属铜,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O,故答案为:Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O;
(5)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:不合理;因为该方案操作步骤多、时间长,消耗试剂量大.
点评:本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.

练习册系列答案
相关题目