题目内容
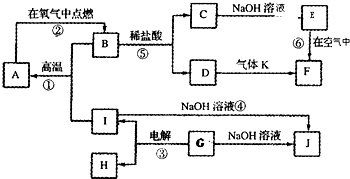
A~J分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态两性氧化物,A是一种金属单质,F是一种红褐色固体,A、B、C、D、E、F六种物质中均含同一种元素,请填写下列空白:
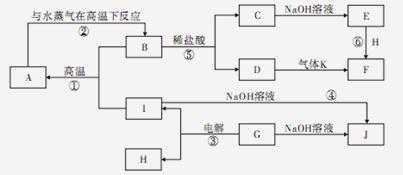
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中的位置是 。
(2)B的化学式: ,K的电子式: 。
(3)写出④的离子方程式: 。
(4)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH 7(填“>”、“<”或“=”),用离子方程式表示其原因: 。
(1)第四周期、第Ⅷ族(2分)
(2)Fe3O4(1分) 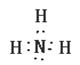 (1分)
(1分)
(3)2Al+2OH一+2H2O==2AlO一+3H2↑(2分)
(4)<(2分)NH![]() +H2O
+H2O ![]() NH3·H2O+H+(2分)
NH3·H2O+H+(2分)

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
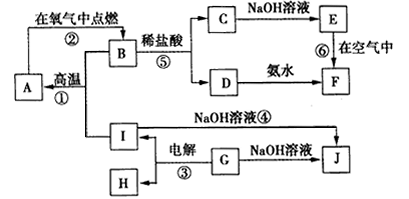
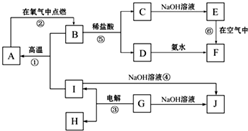 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
 NH3?H2O+H+
NH3?H2O+H+