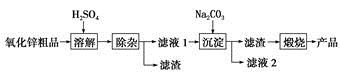
题目内容
常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
| A.c(H+) | B. |
| C.c(H+)·c(OH-) | D. |
A
B项变形,分子、分母同乘以溶液中的c(CH3COO-),
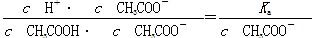
由于加水稀释时,c(CH3COO-)变小,因而B项比值增大;C项是Kw,不受浓度的影响;D项变形,分子、分母同乘以溶液中的c(H+),得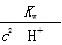 ,由于加水稀释时c(H+)减小,比值变大。
,由于加水稀释时c(H+)减小,比值变大。
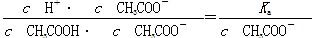
由于加水稀释时,c(CH3COO-)变小,因而B项比值增大;C项是Kw,不受浓度的影响;D项变形,分子、分母同乘以溶液中的c(H+),得
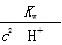 ,由于加水稀释时c(H+)减小,比值变大。
,由于加水稀释时c(H+)减小,比值变大。
练习册系列答案
相关题目
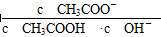 不变
不变