题目内容
将6.4克Cu投入到一定量的硝酸溶液中,Cu全部溶解,溶液中剩余H+amol则溶液中含NO3-的物质的量为mol.
- A.0.2
- B.a
- C.0.2+a
- D.不能确定
分析:根据Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,利用Cu(NO3)2中Cu与NO3-的关系及剩余硝酸来分析.
解答:由Cu投入到一定量的硝酸溶液中,发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
可知Cu~2NO3-,
n(Cu)=
 =0.1mol,
=0.1mol,则溶液中n(NO3-)=0.1mol×2=0.2mol,
又溶液中剩余H+amol,则剩余硝酸中n(NO3-)=amol,
所以反应后溶液中n(NO3-)=amol+0.2mol=(0.2+a)mol,
故选C.
点评:本题考查硝酸的化学性质,明确反应及Cu与硝酸根离子的关系是解答本题的关键,难度不大.

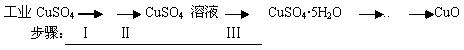
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
⑴ 步骤Ⅰ的目的是除不溶性杂质。所需操作的名称是________、________。
⑵ 步骤Ⅱ的目的是除硫酸亚铁。操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①写出用H2O2溶液除去硫酸亚铁的离子方程式____________________________。
②调整pH 的范围应该在____________之间。
⑶ 步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是将溶液加热蒸发至有晶膜出现时,停止加热,_____________,水浴加热烘干。采用水浴加热的原因是____ 。
⑷ 该同学用CuSO4溶液进行如下探究实验:取A、B两支试管,分别加入 2 mL 5%H2O2溶液,再向H2O2溶液中分别滴入0.1 mol·L-1 FeCl3和CuSO4溶液各1 mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确________(填正确或错误),请说明原因 。
(5)16克硫酸铜固体投入水中形成1升溶液,则该溶液显 性(填“酸性”或“碱性”或“中性”),溶液中所有阳离子总数 0.1NA(填“等于”或“大于”或“小于”),若在上述新配制溶液加入稀硫酸再加入铁片产生氢气速率会明显加快,原因是 ;室温下、若在上述新配制溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时c(Cu2+)=________________mol·L-1(Kap[Cu(OH)2]=2.2×10-20)。