题目内容
(8分)某工厂排出的废水中含有大量的Fe2+、Cu2+和SO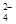 。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。

请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
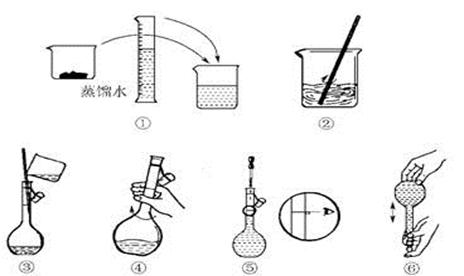
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。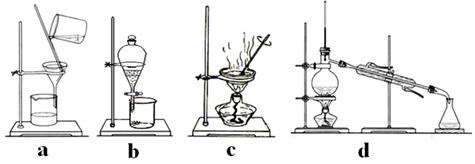
 。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。

(8分)(1)铁粉 ………2分
(2)Fe + 2H+ ="=" Fe2+ + H2↑ ……2分
(3)烧杯、漏斗、玻璃棒 ………2分c…2分
(2)Fe + 2H+ ="=" Fe2+ + H2↑ ……2分
(3)烧杯、漏斗、玻璃棒 ………2分c…2分
工艺流程:废水中加入过量的铁粉,过滤,得到固体为铁和铜的混合物,滤液为硫酸亚铁。再往得到固体混合物中加入稀硫酸,铁溶解,过滤后得到固体铜,此时滤液为硫酸亚铁;对所得滤液硫酸亚铁,进行蒸发结晶操作,得到氯化亚铁晶体。
(1)原料①为铁粉;
(2)Fe + 2H+ ="=" Fe2+ + H2↑
(3)过滤操作用到的玻璃仪器:烧杯、漏斗、玻璃棒。a、过滤;b、萃取分液;c、蒸发结晶;d、蒸馏;硫酸亚铁溶液蒸发结晶得到硫酸亚铁晶体。
(1)原料①为铁粉;
(2)Fe + 2H+ ="=" Fe2+ + H2↑
(3)过滤操作用到的玻璃仪器:烧杯、漏斗、玻璃棒。a、过滤;b、萃取分液;c、蒸发结晶;d、蒸馏;硫酸亚铁溶液蒸发结晶得到硫酸亚铁晶体。

练习册系列答案
相关题目
 aCl2溶液,如果生成白色沉淀,则原溶液中一定有SO42—
aCl2溶液,如果生成白色沉淀,则原溶液中一定有SO42— ,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液
,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液