题目内容
|
25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol.下列热化学方程式书写正确的是 | |
| [ ] | |
A. |
2H+(aq)+SO |
B. |
KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(I);ΔH=-57.3 kJ/mol |
C. |
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O;ΔH=-5518 kJ/mol |
D. |
2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1);ΔH=-5518 kJ/mol |

 名校课堂系列答案
名校课堂系列答案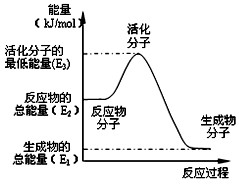 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol -1
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A、反应②中的能量变化如图所示,则△H2=E1-E3 |
| B、CH3OH的燃烧热△H=-192.9 kJ?mol -1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量 |
| D、根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ |
| A、将等质量硫蒸气和硫粉分别完全燃烧,前者放出热量多 | B、由“C(石墨)=C(金刚石);△H=+l.9 kJ?mol-1”可知金刚石比石墨稳定 | C、稀的强酸和稀的强碱溶液反应的热化学方程式均为:H++OH-=H2O(l);△H=-57.3 kJ?mol-1 | D、在25℃、101 kPa时.1克氢气完全燃烧生成H2O放出热量142.9 kJ.则:2H2O(l)=2H2(g)+O2(g);△H=+285.8 kJ?mol-1 |
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
|
元素 |
部分结构知识 |
部分性质 |
|
X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
|
Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
|
Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
|
W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
1、X单质分子的结构式是 ,Z元素原子最外层共有_____种不同运动状态的电子。
2、X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是 。
3、常温时,W的硫酸盐溶液的pH 7(填“=”、“>”或“<”),理由是:
(用离子方程式表示)。
4、25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。