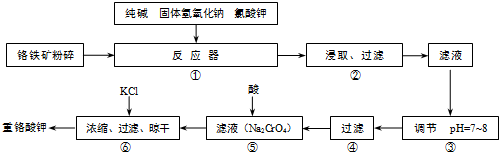
题目内容
填写表中空格
| 物质 | 分子数 | 质量/g | 物质的量/mol |
| O2 | 16.0 | ||
| H2SO4 | 6.02*1023 | ||
| H2O | 2 |
分析:依据n=
=
=
计算关系进行计算分析;
| m |
| M |
| N |
| NA |
| V |
| Vm |
解答:解:O2物质的量n(O2)=
=0.5mol;分子数N=6.02×1023×0.5=3.01×1023;
H2SO4物质的量n(H2SO4)=
=1.0mol,质量m=nM=1mol×98g/mol=98g;
H2O的分子数=nNA=2mol×6.02×1023/mol=1.204×1024;质量m=nM=2mol×18g/mol=36g;
故答案为:
| 16.0g |
| 32g/mol |
H2SO4物质的量n(H2SO4)=
| 6.02×1023 |
| 6.02×1023/mol |
H2O的分子数=nNA=2mol×6.02×1023/mol=1.204×1024;质量m=nM=2mol×18g/mol=36g;
故答案为:
| 物质 | 分子数 | 质量/g | 物质的量/mol |
| O2 | 3.01×1023 | 16.0 | 0.5 |
| H2SO4 | 6.02×1023 | 98 | 1.0 |
| H2O | 1.204×1024 | 36 | 2 |
点评:本题考查了物质的量和气体体积、物质质量、微粒数等量的换算关系计算应用,注意各量的单位计算,题目较简单.

练习册系列答案
相关题目
某学习小组在通过反应Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3名称为硫代硫酸钠,俗称海波,可以看成是用一个S原子取代了Na2SO4中的一个O原子而形成.该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究验证自己的预测.
【提出假设】
(1)部分学生认为Na2S2O3与N2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH 7(填“>”、“=”或“<”).
(2)部分学生从S元素化合价推测Na2S2O3与SO2性质相似,均具有较强的 .
【实验探究】
取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)
【实验结论】
(6)探究①: .
(7)探究②: .
【问题讨论】
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案是否正确并说明理由 .
(9)请你重新设计二个实验方案,证明Na2S2O3被氯水氧化.你的方案是 .
【提出假设】
(1)部分学生认为Na2S2O3与N2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH
(2)部分学生从S元素化合价推测Na2S2O3与SO2性质相似,均具有较强的
【实验探究】
取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | (3) |
溶液pH=8 | (4) |
| 探究② | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5) |
(6)探究①:
(7)探究②:
【问题讨论】
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案是否正确并说明理由
(9)请你重新设计二个实验方案,证明Na2S2O3被氯水氧化.你的方案是
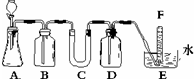 在呼吸面具和潜水艇中可用过氧化纳作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化纳作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂. (2009?清远模拟)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用右图中的实验装置进行实验,证明过氧化钠可作供氧剂.
(2009?清远模拟)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用右图中的实验装置进行实验,证明过氧化钠可作供氧剂.