题目内容
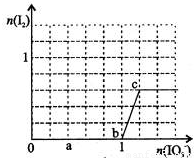
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是

A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
C
【解析】
试题分析:还原性HSO-3>I-,所以首先发生的离子反应是3HSO3-+IO3-=3SO42-+I-+3H+。继续加入KIO3,已知氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2,根据发生的反应,则:A、根据图像可知,0~b间没有单质碘生成,所以反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+,A正确;B、根据图像可知,a点碘酸钾的物质的量是0.04mol,所以根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,消耗NaHSO3的物质的量为0.04mol×3=0.12mol,B正确;C、设生成的碘单质的物质的量为n,则溶液中I—的物质的量是2.5n。则根据反应IO3-+6H++5I-=3H2O+3I2可知,消耗的KIO3的物质的量为 ,消耗碘离子的量为
,消耗碘离子的量为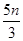 。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-
。根据反应3HSO3-+IO3-=3SO42-+I-+3H+可知,0.3molNaHSO3的溶液消耗KIO3溶液的物质的量为0.1mol,生成碘离子的物质的量也是0.1mol,则0.1mol-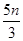 =2.5n,解得
=2.5n,解得 =
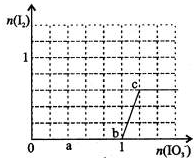
= mol,所以消耗碘酸钾的物质的量是(
mol,所以消耗碘酸钾的物质的量是( +0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。
+0.1mol)=0.108mol,C不正确;D、根据以上分析可知,b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2,D正确,答案选C。
考点:考查氧化还原反应的有关判断和计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案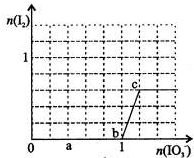 已知:还原性HSO-3>I-,氧化性IO-3>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如右图所示.下列有关说法正确的是( )
已知:还原性HSO-3>I-,氧化性IO-3>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如右图所示.下列有关说法正确的是( )
 mol
mol