题目内容
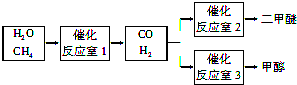
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有广泛的开发和应用前景.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)工业上一般采用下列两种反应成甲醇:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
上述反应符合“原子经济”原则的是
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气体CO2,其化学方程式为
(3)若利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
则反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)△H=
(4)某实验小组依据甲醇燃烧的反应原理,设计如图1所示的电池装置.则该电池正极的电极反应为:

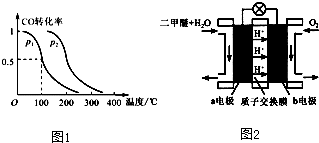
(5)甲醇质子交换膜燃料电池(如图2所示)是以酸性溶液为电解质溶液,甲醇从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入甲醇的一极电极反应式为:

请填空:
(1)工业上一般采用下列两种反应成甲醇:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
上述反应符合“原子经济”原则的是
Ⅰ
Ⅰ
(填“Ⅰ”或“Ⅱ”).(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气体CO2,其化学方程式为
3CO+3H2?CH3OCH3+CO2
3CO+3H2?CH3OCH3+CO2
.(3)若利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
则反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)△H=
-246.4
-246.4
kJ/mol.(4)某实验小组依据甲醇燃烧的反应原理,设计如图1所示的电池装置.则该电池正极的电极反应为:
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.
(5)甲醇质子交换膜燃料电池(如图2所示)是以酸性溶液为电解质溶液,甲醇从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入甲醇的一极电极反应式为:
CH3OH+H2O-6e-═6H++CO2
CH3OH+H2O-6e-═6H++CO2
.分析:(1))“原子经济”原则是指原子利用率高的原则;
(2)依据流程分析判断是一氧化碳和氢气反应生成二甲醚和二氧化碳;
(3)依据热化学方程式 和盖斯定律计算得到;
(4)燃料电池的正极反应是氧气得电子的过程,总反应是燃料的燃烧反应;
(5)酸性电解质溶液中甲醇在负极失电子发生氧化反应生成二氧化碳.
(2)依据流程分析判断是一氧化碳和氢气反应生成二甲醚和二氧化碳;
(3)依据热化学方程式 和盖斯定律计算得到;
(4)燃料电池的正极反应是氧气得电子的过程,总反应是燃料的燃烧反应;
(5)酸性电解质溶液中甲醇在负极失电子发生氧化反应生成二氧化碳.
解答:解:(1)化合反应的原子利用率最高,为100%,故答案为:Ⅰ;
(2)已知反应室2的可逆反应除生成二甲醚外还生成了气体CO2,其化学方程式为3CO+3H2?CH3OCH3+CO2,故答案为:3CO+3H2?CH3OCH3+CO2;
(3)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
依据盖斯定律②+③+①×2得到3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)△H=-246.4KJ/mol;
则反应热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)△H=-246.4KJ/mol
故答案为:-246.4;
(4)甲醇燃烧的反应原理是:正极反应一定是氧气得电子的过程,在碱性环境下,得到氢氧根离子,即O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(5)以酸性溶液为电解质溶液,甲醇从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入甲醇的一极电极反应式为CH3OH+H2O-6e-═6H++CO2,
故答案为:CH3OH+H2O-6e-═6H++CO2.
(2)已知反应室2的可逆反应除生成二甲醚外还生成了气体CO2,其化学方程式为3CO+3H2?CH3OCH3+CO2,故答案为:3CO+3H2?CH3OCH3+CO2;
(3)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
依据盖斯定律②+③+①×2得到3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)△H=-246.4KJ/mol;
则反应热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)△H=-246.4KJ/mol
故答案为:-246.4;
(4)甲醇燃烧的反应原理是:正极反应一定是氧气得电子的过程,在碱性环境下,得到氢氧根离子,即O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(5)以酸性溶液为电解质溶液,甲醇从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入甲醇的一极电极反应式为CH3OH+H2O-6e-═6H++CO2,
故答案为:CH3OH+H2O-6e-═6H++CO2.
点评:本题考查了热化学方程式和盖斯定律计算应用,原电池原理应用,电极反应书写方法,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,其两极的电极反应式为: 2CH3 OH+16OH-―12e-=2CO32-+12H2O , 6H2O+3O2+12e-=12OH-,关于此电池的推断正确的是( )
| A.通入氧气的一极是负极 |
| B.放电时,溶液中的OH-向正极移动 |
| C.反应中若有6mol电子发生转移,则有32g CH3 OH被还原 |
| D.该电池工作时甲醇一极附近溶液的pH降低 |