题目内容
1.实验室里用图所示装置制取纯净氯气,试回答下列问题:
(1)写出烧瓶中发生反应的离子方程式MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)B处盛有饱和食盐水,其作用是吸收氯化氢气体;
(3)E处可放的物质是B;A.浓硫酸 B.碳酸钠 C.饱和食盐水 D.水
(4)C处盛放的试剂是浓硫酸;
(5)若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于11.2L(标况下)(填“大于”、“等于”或“小于”),原因是随着反应的进行,盐酸的浓度逐渐减小,稀盐酸与二氧化锰不再反应,故应小于11.2L.
分析 (1)二氧化锰在加热条件下能够氧化浓盐酸生成氯气;
(2)氯化氢易挥发,制备的氯气中含有杂质氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,据此除去氯化氢;
(3)氯气有毒,不能直接排放,用来进行尾气处理的物质应能够与氯气反应的物质;
(4)浓硫酸具有吸水性,能够干燥氯气;
(5)二氧化锰只能够与浓盐酸反应,与否稀盐酸不反应,随着反应的进行,盐酸的浓度逐渐减小,稀盐酸与二氧化锰不再反应,据此解答.
解答 解解:(1)浓盐酸与二氧化锰在加热条件下反应离子方程式:MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)氯化氢易挥发,制备的氯气中含有杂质氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,可以用饱和食盐水除去氯气中的氯化氢,
故答案为:吸收氯化氢气体;
(3)A.氯气与浓硫酸不反应,不能进行尾气处理,故A不选;
B.氯气与水反应生成盐酸与次氯酸,盐酸与碳酸钠反应,能够吸收氯气,故B选;
C.氯气在饱和食盐水中溶解度不大,不能吸收氯气,故C不选;
D.氯气在水中溶解度不大,用水吸收氯气,吸收不充分,故D不选;
故选:B;
(4)氯气中含有水蒸气,浓硫酸具有吸水性,能够干燥氯气,
故答案为:浓硫酸;
(5)浓盐酸中含有HCl:0.2L×10mol/L═2mol根据化学方程式:可知在二氧化锰过量的条件下,如果HCl完全反应,会生成氯气0.5mol,体积标况下为:11.2L,但是随着反应的进行,盐酸的浓度逐渐减小,稀盐酸与二氧化锰不再反应,所以生成的氯气体积应小于11.2L;
故答案为:小于;随着反应的进行,盐酸的浓度逐渐减小,稀盐酸与二氧化锰不再反应,故应小于11.2L.
点评 本题考查了氯气的制备和性质的检验,明确反应原理是解题关键,注意二氧化锰只能氧化浓盐酸,与稀盐酸不反应,足量二氧化锰与定量浓盐酸反应,生成的氯气小于理论数值,题目难度不大.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | H2O | B. |  | C. |  | D. | H2N-CH2-COOH |
| A. | NH3(g)+HCl(g)→NH4Cl(s),该反应可自发进行,故熵值增大 | |
| B. | SO2(g)→S(s)+O2(g)△H>0,△S<0.则该反应能自发进行 | |
| C. | O2(g)+2H2(g)═2H2O(l)△H<0,恒温恒压下一定能自发进行 | |
| D. | 某温度下2SO2(g)+O2(g)═2SO3(g),K1=400,则相同温度下2SO3(g)?2SO2(g)+O2(g)的平衡常数为$\frac{1}{400}$ |

| A. | P3=P4,y轴表示C的体积分数 | |
| B. | P3<P4,y轴表示B的质量分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |

| A. | P2>P1,m+n>p+q | B. | P1>P2,m+n>p+q | C. | T1>T2,△H<0 | D. | T2>T1,△H>0 |
| A. | 2,4,6-三硝基甲苯 | B. | 3-甲基-1,3-丁二烯 | ||
| C. | 1,1,2,2-四甲基戊烷 | D. | 2-甲基-3-丁醇 |
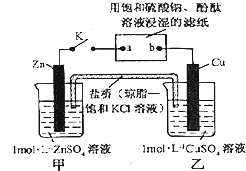
| A. | Cu电极上发生氧化反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(K+)增大 | D. | 片刻后可观察到滤纸a点变红色 |
