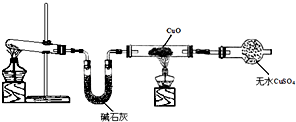
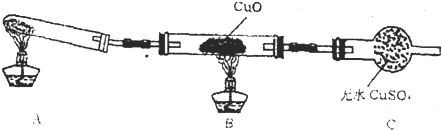
��Ŀ����
��֪��Cu2O��һ�ּ������������ϡ��������Cu��CuSO4��������������������ͭ���Ǻ�ɫ��ĩ�����������ϡ�ij��ѧ��ȤС��ͨ��ʵ����̽��ij��ɫ��ĩ��Fe2O3��Cu2O�����ߵĻ�����ʵ�������Լ�ֻ�ܴ�������ѡ��ϡ���ᡢKSCN��Һ��ϡ���ᡢ˫��ˮ�����ۡ���ʽ̼��ͭ��
̽������������ɫ��ĩ����������ϡ�����У�ʵ������Ӧ���к�ɫ������ڣ�
��1�����ۣ���ɫ��ĩ�� ��
��2�������ɫ��ĩ��Cu2O������Fe2O3�Ļ��������ʵ��֤��֮��
ʵ�������
ʵ������
��3����ȤС��������Fe2O3��Cu2O�Ļ������ȡ�ϴ����ĵ�����CuSO4��5H2O�������������ϵ�֪������Һ��ͨ��������Һ������Զ�ʹCu2+��Fe2+��Fe3+�ֱ����ɳ�����pH���£�
| ���� | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| ��ʼ������pH | 6.4 | 9.7 | 1.9 |
| ������ȫ��pH | 9.6 | 12.7 | 3.7 |
ʵ��С���������ʵ�鷽����
�Իش�
���Լ�1Ϊ ���Լ�2Ϊ �������ƣ���
�����Լ�1������Ӧ�����ӷ���ʽΪ________________________��_______________________��
�ڹ���X�Ļ�ѧʽΪ ��
�۲���1Ϊ ��
��1��Cu2O��Fe2O3��Cu2O�Ļ�����2�֣�
��2��ȡ������ɫ��ĩ��������ϡ�����У�����ܽ��μ�KSCN��Һ���ٵμ�˫��ˮ��2�֣���
�к�ɫ�������ɣ���KSCN��Һ���Ժ�ɫ���ټ�˫��ˮ���Ժ�ɫ��2�֣���
��3����˫��ˮ��2�֣�����ʽ̼��ͭ��2�֣���
Cu+ H2O2 + 2H+== Cu2+ + 2H2O��2�֣� 2Fe2+ + H2O2 + 2H+== 2Fe3+ + 2H2O��2�֣�
��Fe(OH)3��2�֣���������Ũ������ȴ�ᾧ����2�֣�
����:��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
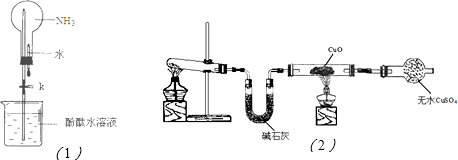
 ��
��