题目内容
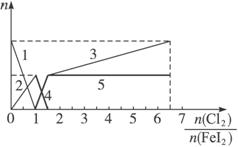
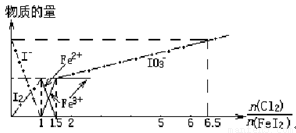
向FeI2溶液中不断通入Cl2,溶液中I-、I2、 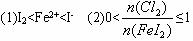
分析图中信息,完成下列各题:
(1)Fe2+、I-、I2的还原性由弱到强的顺序是__________________。
(2)当____________时(填写![]() 的取值范围),发生反应的离子方程式为2I-+Cl2====I2+2Cl-。
的取值范围),发生反应的离子方程式为2I-+Cl2====I2+2Cl-。
![]()
![]()
![]()
(3)6Cl2+2Fe2++10I-====12Cl-+5I2+2Fe3+ (4)![]()
解析:从图中看出,当I-消耗完时Fe2+开始减少,Fe2+氧化完时![]() 开始增加,说明还原性I->Fe2+>I2。因此向FeI2溶液中不断通入Cl2,发生的化学反应为:①Cl2+2I-====2Cl-+I2,②Cl2+2Fe2+====2Cl-+2Fe3+,③5Cl2+I2+6H2O====10Cl-+2IO-3+12H+,当0<
开始增加,说明还原性I->Fe2+>I2。因此向FeI2溶液中不断通入Cl2,发生的化学反应为:①Cl2+2I-====2Cl-+I2,②Cl2+2Fe2+====2Cl-+2Fe3+,③5Cl2+I2+6H2O====10Cl-+2IO-3+12H+,当0<![]() ≤1时,反应按①式进行;当1<
≤1时,反应按①式进行;当1<![]() ≤1.5时,反应按①②式进行;当
≤1.5时,反应按①②式进行;当![]() >1.5时,反应按①② ③式进行。
>1.5时,反应按①② ③式进行。
设FeI2为1 mol,氧化I-需Cl2 1 mol,氧化Fe2+需Cl2 0.5 mol。
剩余Cl2 5 mol-1 mol-0.5 mol=3.5 mol
据5Cl2—2![]()
5 2
3.5 ![]()


练习册系列答案
相关题目
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子的物质的量随n(Cl2):n(FeI2)的变化可用如图简单表示,下列有关说法中正确的是( )
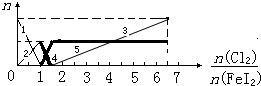

| A、粗线5、细线3分别代表n(Fe3+)、n(IO3-)随n(Cl2):n(FeI2)变化的情况 | B、假设通入Cl2的过程中溶液的体积不变,则溶液的pH始终不变 | C、当n(Cl2):n(FeI2)=6.5时,溶液中n(Cl-):n(IO3-)=13 | D、当n(Cl2):n(FeI2)=1.2时,离子方程式可表示为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl- |