题目内容
在含有0.1molAlCl3的溶液中,加入一定量的NaOH,若生成3.9gAl(OH)3沉淀,则须滴加3mol/L的NaOH溶液的体积可能是( )
分析:根据AlCl3的物质的量和Al(OH)3沉淀的质量判断出AlCl3没有完全生成Al(OH)3沉淀,存在两种情况:NaOH不足;NaOH过量,部分生成NaAlO2,根据反应的化学方程式讨论计算.
解答:解:n(AlCl3)=0.1mol,
Al(OH)3沉淀的物质的量为
=0.05mol,
则AlCl3没有完全生成Al(OH)3沉淀,存在两种情况:
(1)NaOH不足,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
3 1
n 0.05mol
n=0.15mol,
V(NaOH)=
=0.05L,即50ml,
(2)NaOH过量,部分生成NaAlO2,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1 3 1
0.1mol 0.3mol 0.1mol
Al(OH)3+NaOH=NaAlO2+2H20
1 1
0.05mol 0.05mol
共需n(NaOH)=0.3mol+0.05mol=0.35mol,
V(NaOH)=
=
=0.1167L,即116.7ml,
故选BC.
Al(OH)3沉淀的物质的量为
| 3.9g |
| 78g/mol |
则AlCl3没有完全生成Al(OH)3沉淀,存在两种情况:
(1)NaOH不足,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
3 1
n 0.05mol
n=0.15mol,
V(NaOH)=
| 0.15mol |
| 3mol/L |
(2)NaOH过量,部分生成NaAlO2,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1 3 1
0.1mol 0.3mol 0.1mol
Al(OH)3+NaOH=NaAlO2+2H20
1 1
0.05mol 0.05mol
共需n(NaOH)=0.3mol+0.05mol=0.35mol,
V(NaOH)=
| n |
| c |
| 0.35mol |
| 3mol/L |
故选BC.
点评:本题考查化学方程式的计算,题目难度中等,注意根据反应物的物质的量和沉淀的质量判断反应的程度,用讨论的方法计算.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。
 已知:1molA和1mol B完全燃烧的耗氧量如下:
已知:1molA和1mol B完全燃烧的耗氧量如下:
| 物 质 | A | B |
| n(O2)/mol | 1.500 | 12.50 |
A、 B按不同比例混合的燃料91.20g,在足量的氧气中燃烧时,耗氧量与
混合燃料中B的物质的量分数x的关系如右图。
(1)相对分子质量:A为____________,B为______________。
(2)73.00g由A、B等物质的量混合而成的燃料,在160.0 L
O2中完全燃烧,得到104.0L气体,通过碱石灰充分吸收后,剩余3.200L气体(气体体积均在标准状况下测定)。由此可推得混合物中N(C):N(H):N(O)= ,则:A分子式为 ,B分子式为 。
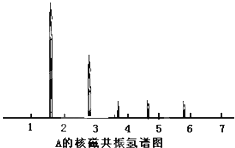 为测定某有机化合物A的结构,进行如下实验.
为测定某有机化合物A的结构,进行如下实验.