题目内容
(12分)实验室需要0.1mol/LNaOH溶液450mL,根据溶液配制中情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其它仪器有:
。
(2)根据计算得知,所需NaOH的质量为 g。
(3)下列操作对所配浓度有何影响(填写字母)偏大的有 ;偏小的有 ;无影响的有 。
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其它仪器有:
。
(2)根据计算得知,所需NaOH的质量为 g。
(3)下列操作对所配浓度有何影响(填写字母)偏大的有 ;偏小的有 ;无影响的有 。
| A.称量用了生锈的砝码; |
| B.将NaOH放在纸张上称量; |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中; |
| D.往容量瓶转移时,有少量液体溅出 |
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
⑴玻璃棒、胶头滴管、量筒等⑵2.0g ⑶偏大的有A、C;
偏小的有;B、D、E 、F、H 无影响的有G。
偏小的有;B、D、E 、F、H 无影响的有G。
本题将实验室配制一定物质的量浓度溶液的方法及误差分析放在一起,考查学生对该实验的掌握情况。对于真正做过这个实验和没有做过而仅凭背实验的学生来讲,效果肯定会有很大差别,这也是出题的目的。
(1)中考查该实验所需仪器,一般容易忘记胶头滴管和玻璃棒,记忆时要学会“有序记忆”——即按照实验的先后顺序、步骤,思考每一步所需仪器,然后进行记忆,则一定不会遗漏。(2)步比较简单,要按500mL进行计算。(3)步是误差分析,需要细心认真分析错误操作如何导致浓度变化。
(1)中考查该实验所需仪器,一般容易忘记胶头滴管和玻璃棒,记忆时要学会“有序记忆”——即按照实验的先后顺序、步骤,思考每一步所需仪器,然后进行记忆,则一定不会遗漏。(2)步比较简单,要按500mL进行计算。(3)步是误差分析,需要细心认真分析错误操作如何导致浓度变化。

练习册系列答案
相关题目

 Mg2+ +2OH-
Mg2+ +2OH-
 O2
O2 溶液反应时有气体放出。A经下列反应可逐步生成B~G。
溶液反应时有气体放出。A经下列反应可逐步生成B~G。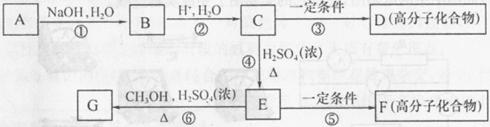
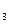 ;②能发生银镜反应;③属于酯类。则其结构简式为(写3种):
;②能发生银镜反应;③属于酯类。则其结构简式为(写3种): 5)写化学方程式(有机物写结构简式):
5)写化学方程式(有机物写结构简式):