题目内容
可逆反应N2+3H2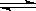 2NH3 △H<0。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3 molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=3Q1,则甲容器中,H2的转化率为
2NH3 △H<0。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3 molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=3Q1,则甲容器中,H2的转化率为
| A.10% | B.20% | C.25% | D.40% |
C
解析试题分析:根据题意甲、乙两个容器中的平衡状态是等效的,设甲中氢气的转化率是x,则生成氨气的物质的量是2x,所以再乙容器中分解的氨气是2-2x,则根据Q2=3Q1可知(1-x)·△H=3x·△H,解得x=0.25,答案选C。
考点:考查反应热的应用以及可逆反应转化率的计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,综合性强,侧重对学生解题能力的培养和训练,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确两种状态下平衡是等效的,然后根据题意再列式计算即可。

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
