题目内容
下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是
①2HClO4+Br2(气) = 2HBrO4+Cl2
②2NaBr+Cl2= 2NaCl+Br2
③2KI+Cl2= 2KCl+I2
④2KI+Br2= 2KBr+I2
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
C
解析试题分析:卤素非金属性越强,氧化性越强。反应中氧化剂的氧化性强于氧化产物,①Br2为还原剂,其还原性强于Cl2;② 氧化性Cl2>Br2;③ 氧化性Cl2>I2;④Br2>I2;故得出氧化性Cl2>Br2>I2,非金属性活泼顺序是Cl>Br>I。
考点:考查氧化性强弱的比较有关问题。

根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-...... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
已知Fe3O4可表示成(FeO· Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2+ +2S2O32-+O2+4OH-= Fe3O4 +S4O62-+2H2O 下列说法不正确的是( )
| A.O2是氧化剂,S2O32-、Fe2+是还原剂 |
| B.当有1 mol Fe3O4 生成时共转移的电子为4mol |
| C.若有3mol Fe2+参加反应,则被Fe2+还原的O2为1mol |
| D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.反应后的溶液中n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
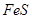 与一定浓度的
与一定浓度的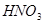 反应,生成
反应,生成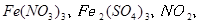
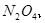
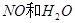 ,当
,当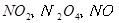 的物质的量之比为
的物质的量之比为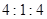 时,实际参加反应的
时,实际参加反应的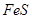 与
与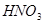 的物质的量之比为( )。
的物质的量之比为( )。
| A.1:6 | B.2:15 | C.2:3 | D.16:25 |
已知氧化还原反应反应 K2Cr2O7 + 14HCl ="=" 2KCl + 2CrCl3 + 3Cl2+ 7H2O
="=" 2KCl + 2CrCl3 + 3Cl2+ 7H2O
关于该反应的说法中正确的组合是
①氧化剂是K2Cr2O7 ②还原性:Cl->Cr3+
③每生成1mol Cl2,电子转移为6mol ④CrCl3是氧化产物
| A.①② | B.①②④ | C.①③④ | D.①③ |
下列说法正确的是
| A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强 |
| B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为: Fe3+ > Cu2+ > Fe2+ |
| C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C- + B2 = 2B- +C2都能发生 |
| D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
ClO2是一种消毒杀菌效率高、污染小的水处理剂。实验室可通过以下反应制得ClO2。2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
| A.KClO3在反应中是还原剂 |
| B.1 mol KClO3参加反应,在标准状况下能得到22.4 L气体 |
| C.在反应中H2C2O4既不是氧化剂也不是还原剂 |
| D.1 mol KClO3参加反应有1 mol电子转移 |
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O。与上述反应在氧化还原原理上最相似的是( )
| A.2NaBr+Cl2=2NaCl+Br2 |
| B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl |
| C.2H2S+SO2=2H2O+3S |
| D.2FeCl3+H2S=2FeCl2+S↓+2HCl |