题目内容
将250mL密度1.31g/cm3、质量分数为15%的硫酸与适量的铁屑充分反应.计算:
(1)此硫酸溶液中H2SO4的物质的量浓度;
(2)生成的H2的体积(标况);
(3)将生成的FeSO4配成400mL溶液,此溶液中Fe2+的物质的量浓度.
解:(1)密度1.31g/cm3、质量分数为15%的硫酸,
由c= 可知,c=
可知,c=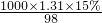 =2.0mol/L,
=2.0mol/L,
答:此硫酸溶液中H2SO4的物质的量浓度为2mol/L;
(2)H2SO4的物质的量为0.25L×2.0mol/L=0.5mol,
由H2SO4~H2可知,H2的物质的量为0.5mol,
则H2的体积为0.5mol×22.4L/mol=11.2L,
答:生成的H2的体积为11.2L;
(3)H2SO4的物质的量为0.25L×2.0mol/L=0.5mol,
由H2SO4~FeSO4可知,FeSO4的物质的量为0.5mol,
则Fe2+的物质的量浓度为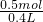 =1.25mol/L,
=1.25mol/L,
答:溶液中Fe2+的物质的量浓度为1.25mol/L.
分析:(1)根据c= 来计算;
来计算;
(2)根据H2SO4~H2来分析H2的物质的量,然后利用V=n×Vm来计算其体积;
(3)根据H2SO4~FeSO4来分析FeSO4的物质的量,再利用c= 来计算.
来计算.
点评:本题考查物质的量浓度的简单计算,明确浓度、体积、物质的量的关系,化学反应中各物质的关系、物质与物质中离子的关系即可解答.
由c=
 可知,c=
可知,c=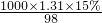 =2.0mol/L,
=2.0mol/L,答:此硫酸溶液中H2SO4的物质的量浓度为2mol/L;
(2)H2SO4的物质的量为0.25L×2.0mol/L=0.5mol,
由H2SO4~H2可知,H2的物质的量为0.5mol,
则H2的体积为0.5mol×22.4L/mol=11.2L,
答:生成的H2的体积为11.2L;
(3)H2SO4的物质的量为0.25L×2.0mol/L=0.5mol,
由H2SO4~FeSO4可知,FeSO4的物质的量为0.5mol,
则Fe2+的物质的量浓度为
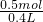 =1.25mol/L,
=1.25mol/L,答:溶液中Fe2+的物质的量浓度为1.25mol/L.
分析:(1)根据c=
 来计算;
来计算;(2)根据H2SO4~H2来分析H2的物质的量,然后利用V=n×Vm来计算其体积;
(3)根据H2SO4~FeSO4来分析FeSO4的物质的量,再利用c=
 来计算.
来计算.点评:本题考查物质的量浓度的简单计算,明确浓度、体积、物质的量的关系,化学反应中各物质的关系、物质与物质中离子的关系即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(10分)为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签。某学生欲在实验室中配制500 mL该葡萄糖注射液。
| 葡萄糖注射液 |
| 规格:250mL(密度:1.08g·mL-1) 生产批号:1003203 2 有效期:至2013年10月 5% |
(1)还缺少的仪器有 。
(2)下列对容量瓶及使用的描述中不正确的是 。
A.容量瓶上标有容积、温度和浓度
B.使用前要检查容量瓶是否漏水
C.容量瓶用蒸馏水洗净后,再用5%葡萄糖注射液洗
D.配制溶液时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
(3)实验中需取用固体的质量为 g,该葡萄糖注射液的物质的量浓度 mol/L.。
(4)配制该葡萄糖注射液,下列操作会导致所配溶液的物质的量浓度偏高的是 。
A.没有将洗涤液转移到容量瓶 B.定容时俯视刻度线
C.容量瓶洗净后未干燥 D.定容时液面超过了刻度线