题目内容
(2009?茂名二模)有100mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0mol?L-1,c(Mg2+)=0.2mol?L-1.若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol?L-1的NaOH溶液的体积是( )
分析:操作的目的是氢氧化镁形成沉淀从溶液中分离出来,需要加入过量的碱把生成的氢氧化铝沉淀恰好全部溶解,利用MgCl2和AlCl3与NaOH反应方程式进行计算,然后利用电荷守恒、离子守恒计算.
解答:解:发生反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O;
将Mg2+恰好转化为沉淀分离,需要把Al3+全部转化为AlO2-;观察反应方程式可知,此时,溶液恰好为NaCl和NaAlO2溶液,所以,n(Na+)=n(Cl-)+n(Al3+),
Na+来源于4mol/LNaOH溶液,Al3+、Cl-来源于100mLMgCl2和AlCl3混合液溶液,不考虑水解因素,原溶液中根据电荷守恒2[Mg2+]+3[Al3+]=[Cl-]计算得到[Al3+]=0.2mol/L
由离子守恒知:n(Na+)=n(Cl-)+n(Al3+)=0.1L×1mol/L+0.1L×0.2mol/L=0.12mol,所以,需加4mol/LNaOH溶液体积为:
=0.03L=30ml;
故选C.
将Mg2+恰好转化为沉淀分离,需要把Al3+全部转化为AlO2-;观察反应方程式可知,此时,溶液恰好为NaCl和NaAlO2溶液,所以,n(Na+)=n(Cl-)+n(Al3+),
Na+来源于4mol/LNaOH溶液,Al3+、Cl-来源于100mLMgCl2和AlCl3混合液溶液,不考虑水解因素,原溶液中根据电荷守恒2[Mg2+]+3[Al3+]=[Cl-]计算得到[Al3+]=0.2mol/L
由离子守恒知:n(Na+)=n(Cl-)+n(Al3+)=0.1L×1mol/L+0.1L×0.2mol/L=0.12mol,所以,需加4mol/LNaOH溶液体积为:
| 0.12mol |
| 4mol/L |
故选C.
点评:本题考查了镁离子铝离子混合溶液中分离镁离子的方法应用,主要考查氢氧化铝能溶于强碱中,结合电荷收和离子守恒进行计算,关键是反应过程的分析判断.

练习册系列答案
相关题目





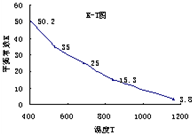 (2009?茂名二模)碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )
(2009?茂名二模)碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )