题目内容
下列对各种平衡体系的叙述中,不正确的是
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
B某温度下,容积一定的密闭容器中进行可逆反应,X(g) +Y(g) 2Z(g)+W(s)
2Z(g)+W(s) 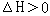 平衡后,升高温度,c(Z)增大
平衡后,升高温度,c(Z)增大
C.常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡正向移动
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:
CH3COO- +H2O
 CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)B某温度下,容积一定的密闭容器中进行可逆反应,X(g) +Y(g)
 2Z(g)+W(s)
2Z(g)+W(s) 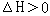 平衡后,升高温度,c(Z)增大
平衡后,升高温度,c(Z)增大C.常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡正向移动
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动
C
试题分析:醋酸钠是强碱弱酸盐,水解显碱性,A正确;B中反应是吸热反应,升高温度平衡向正反应方向移动,Z的浓度增大,B正确;醋酸是弱电解质,存在电离平衡CH3COOH
 CH3COO-+H+,因此加入醋酸钠固体后抑制醋酸的电离,C不正确;盐酸电离出的氢离子能结合CO32-生成CO2和水,促进碳酸钙的溶解,D正确,答案选C。
CH3COO-+H+,因此加入醋酸钠固体后抑制醋酸的电离,C不正确;盐酸电离出的氢离子能结合CO32-生成CO2和水,促进碳酸钙的溶解,D正确,答案选C。点评:该题是高考中的常见考点,属于中等难度试题的考查,试题综合性强,侧重对学生基础知识的巩固和训练,主要是考查学生对四种平衡状态以及外界条件对平衡状态影响的了解程度,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力,有助于提升学生的学科素养。

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
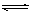 2C(气)△H<0的平衡体系,下列说法错误的是
2C(气)△H<0的平衡体系,下列说法错误的是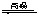 Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为
Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为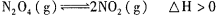 ,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是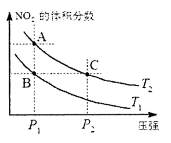
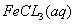 与
与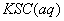 混合时存在下列平衡:
混合时存在下列平衡: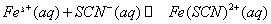 。已知平衡时,物质盼量浓度
。已知平衡时,物质盼量浓度 与温度T的关系如右图所示,则下列说法正确的是
与温度T的关系如右图所示,则下列说法正确的是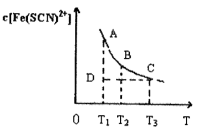

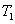 、
、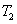 时,反应的平衡常数分别为
时,反应的平衡常数分别为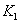 、
、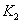 ,则
,则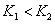
 大
大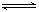 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是