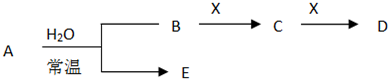题目内容
已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
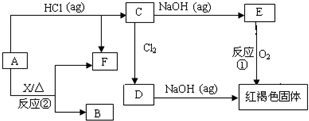
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:
(2)写出下列反应的化学方程式:
反应①
反应②

请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:
Fe3O4、FeCl3
Fe3O4、FeCl3
(2)写出下列反应的化学方程式:
反应①
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
;反应②
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
分析:A是金属单质,与盐酸反应生成C为金属氯化物,C与氢氧化钠反应生成E,E被氧气氧化生成红褐色固体,该红褐色固体为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,故A为Fe.
C与氯气反应生成D为FeCl3,FeCl3能与NaOH溶液反应生成Fe(OH)3.根据转化关系可知,F为氢气,Fe与X再加热的条件下也可以生成氢气,应是Fe与水蒸气的反应生成四氧化三铁越氢气,则X为水,B为四氧化三铁,据此解答.
C与氯气反应生成D为FeCl3,FeCl3能与NaOH溶液反应生成Fe(OH)3.根据转化关系可知,F为氢气,Fe与X再加热的条件下也可以生成氢气,应是Fe与水蒸气的反应生成四氧化三铁越氢气,则X为水,B为四氧化三铁,据此解答.
解答:解:A是金属单质,与盐酸反应生成C为金属氯化物,C与氢氧化钠反应生成E,E被氧气氧化生成红褐色固体,该红褐色固体为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,故A为Fe.
C与氯气反应生成D为FeCl3,FeCl3能与NaOH溶液反应生成Fe(OH)3.根据转化关系可知,F为氢气,Fe与X再加热的条件下也可以生成氢气,应是Fe与水蒸气的反应生成四氧化三铁越氢气,则X为水,B为四氧化三铁,
(1)由上述分析可知,B为Fe3O4,D为FeCl3,
故答案为:Fe3O4、FeCl3;
(2)反应①的方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
反应②的方程式为:3Fe+4H2O(g)
Fe3O4+4H2,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;3Fe+4H2O(g)
Fe3O4+4H2.
C与氯气反应生成D为FeCl3,FeCl3能与NaOH溶液反应生成Fe(OH)3.根据转化关系可知,F为氢气,Fe与X再加热的条件下也可以生成氢气,应是Fe与水蒸气的反应生成四氧化三铁越氢气,则X为水,B为四氧化三铁,
(1)由上述分析可知,B为Fe3O4,D为FeCl3,
故答案为:Fe3O4、FeCl3;
(2)反应①的方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
反应②的方程式为:3Fe+4H2O(g)
| ||
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;3Fe+4H2O(g)
| ||
点评:本题考查无机物的推断,涉及Fe元素单质及其化合物的性质,生成红褐色固体为突破口,再根据转化关系进行推断,掌握Fe单质及化合物性质是关键,反应②推断为易错点、难点,题目没有过多的信息,需要学生熟练掌握Fe与水的反应.

练习册系列答案
相关题目
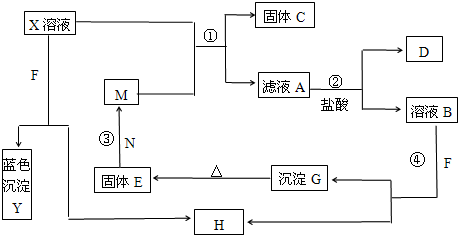
 (2009?滨州模拟)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).
(2009?滨州模拟)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).