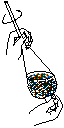题目内容
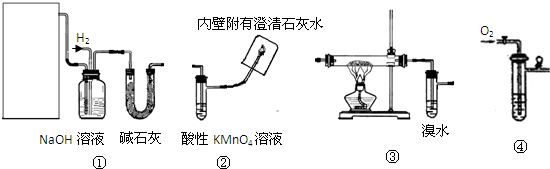
Ⅰ、实验室用甲醇催化氧化法得到甲醛,并验证甲醛的性质.请回答下列问题:
(1)应选择的装置是
(2)若③硬质玻璃管中装有铜粉,请写出硬质玻璃管中发生反应的化学方程式
| 催化剂 |
| △ |
| 催化剂 |
| △ |
(3)实验结束后,观察到溴水褪色.为解释这一现象,某学习小组的同学提出两种猜想:
A.发生了加成反应;
B.发生了氧化反应.为探究哪种猜想正确,学习小组的同学用pH计测溴水褪色前后溶液的pH.测得溶液的pH下降,试写出褪色的化学方程式
Ⅱ、若选择①③②验证乙烯与氢气反应产物,请回答下列问题:
(4)写出实验室制乙烯的化学方程式
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
(5)NaOH溶液的作用是
(6)实验过程中,发现③中溴水褪色,试用化学方程式表示溴水褪色的原因
(7)出现什么现象可说明乙烯与氢气反应生成了乙烷
(2)硬质玻璃管中发生反应有甲醇催化氧化,还有溴水与生成的甲醛发生加成反应;
(3)甲醛被溴单质氧化成了二氧化碳;
(4)乙醇在170℃、浓硫酸存在条件下,能发生消去反应生成乙烯;
(5)氢氧化钠溶液能够除去乙烯中的酸性气体、能够使乙烯与氢气混合、还可以通过观察气泡并调节乙烯与氢气混合的体积之比;
(6)乙烯能够与溴水发生加成反应生成1,2-二溴乙烷;
(7)乙烯与氢气加成后生成了饱和烃乙烷,不会使高锰酸钾溶液褪色;乙烷点燃后生成了二氧化碳.
故答案为:③④(或④③);
(2)发生反应有甲醇催化氧化和溴水与生成的甲醛发生加成反应,反应的方程式为:CH3OH+O2
| 催化剂 |
| △ |
故答案为:CH3OH+O2
| 催化剂 |
| △ |
(3)甲醛被溴单质氧化成了二氧化碳的化学方程式为:HCHO+H2O+2Br2→CO2+4HBr,
故答案为:HCHO+H2O+2Br2→CO2+4HBr;
II、(4)实验室利用乙醇能发生消去反应制乙烯,反应的方程式为:CH3-CH2-OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3-CH2-OH
| 浓硫酸 |
| 170℃ |
(5)通过氢氧化钠溶液,可以除去乙烯中的酸性气体、使乙烯与氢气混合、还可以通过观察气泡并调节乙烯与氢气混合的体积之比,
故答案为:除去乙烯中的酸性气体、使乙烯与氢气混合,③观察气泡并调节乙烯与氢气混合的体积之比(只要答出其中两点即可);
(6)乙烯易和溴加成生成1,2-二溴乙烷,即CH2=CH2+Br-Br→CH2Br-CH2Br,
故答案为:CH2=CH2+Br-Br→CH2Br-CH2Br;
(7)若反应后的气体不能够使高锰酸钾溶液褪色,且点燃后生成了二氧化碳,证明了乙烯与氢气反应生成了乙烷,
故答案为:②中酸性KMnO4溶液不褪色,点燃气体后附有澄清石灰水的烧杯壁出现白色沉淀.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为:
(2)实验室用二氧化锰制取氯气的化学方程式为:
(3)实验室中模拟Br-→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现.写出Br-→Br2的转化离子方程式为:
(4)实验室制备氯气的反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如下图),再把已称好50.0g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应.观察读数变化如下表所示:

| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
①实验中产生的CO2气体质量为
②残余液中盐酸的物质的量浓度为(结果精确到小数点后一位)
| |||||||||||||||||||||||||||||||
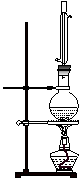
实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。
(甲) (乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
|
| 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶 (9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的
理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①___________________________________________________________________,
②___________________________________________________________________。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。
A B C D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______
______________________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。


(甲) (乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
|
|
乙酸 |
1-丁醇 |
乙酸丁酯 |
|
熔点(℃) |
16.6 |
-89.5 |
-73.5 |
|
沸点(℃) |
117.9 |
117 |
126.3 |
|
密度(g/cm3) |
1.05 |
0.81 |
0.88 |
|
水溶性 |
互溶 |
可溶 (9g/100g水) |
微溶 |
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的
理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①___________________________________________________________________,
②___________________________________________________________________。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。




A B C D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______
______________________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。







 ________________________________________________________。
________________________________________________________。