题目内容
在100℃时,将0.40molNO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
|
分析:由表中数据,60s、80s时四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.3,n2=0.07,n3=n4=0.24,
A.根据v=
计算v(NO2);
B.二氧化氮的浓度越大,混合气体颜色越深;
C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同.
A.根据v=
| ||
| △t |
B.二氧化氮的浓度越大,混合气体颜色越深;
C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同.
解答:解:由表中数据,60s、80s是四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.3,n2=0.07,n3=n4=0.24,
A.v(NO2)=
=0.0025 mol/(L?s),故A错误;
B.60s、80s时处于平衡状态,故颜色一样,但比40s时二氧化氮的浓度低,颜色比40s浅,故B错误;
C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动,即向生成二氧化氮的方向移动,故C错误;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同,故各组分的含量与原平衡相同,故D正确,
故选D.
A.v(NO2)=
| ||
| 20s |
B.60s、80s时处于平衡状态,故颜色一样,但比40s时二氧化氮的浓度低,颜色比40s浅,故B错误;
C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动,即向生成二氧化氮的方向移动,故C错误;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同,故各组分的含量与原平衡相同,故D正确,
故选D.
点评:本题考查化学反应速率计算、化学平衡影响因素、等效平衡等,难度不大,C选项为易错点,注意总压强不变但反应混合气体的分压减小,相当于降低压强.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.(1)对反应2NO2(g)?N2O4(g)△H=-57.2kJ?mol-1
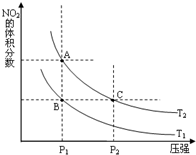
①在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.T1
②A、C两点气体的平均相对分子质量:A
(2)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②该条件下平衡常数K的值为
③若其他条件不变,下列既能加快正反应速率又能提高NO2转化率的措施是
④若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始的物质的量是
⑤若其它条件不变,只将容器改为带活塞的恒压容器,则平衡时N2O4的量
 在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.