题目内容
(1)通过实验测定H2O2溶液中H2O2的质量分数:
①用 (填仪器名称)量取5.00mL H2O2溶液(密度为1.00g?mL-1)置于锥形瓶中加水稀释,再加稀硫酸酸化:
②用0.1000mol?L-1KMnO4溶液滴定,MnO
被还原成Mn2+,反应的离子方程式为 .如何判断滴定终点: ③用相同的方法滴定三次,消耗的KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL.则H2O2溶液中溶质的质量分数为
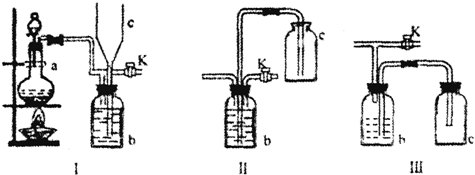
(2)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ].并设想用装置[Ⅱ]或装置[Ⅲ]两种简易装置代替装置[Ⅰ]的b~c部分,以求达到同样的目的.
试回答:
①若用装置[Ⅰ]制取氯气,b瓶加入的液体一般为 .在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时如若发现c中液面上升不明显,你分析可能的原因是 ,检查的简单方法是
②装置[Ⅰ]中b能防止多余气体逸散的原因是:
③欲用装置[Ⅱ]或装置[Ⅲ]代替装置[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由.
装置[Ⅱ]是否可行(填“是”或“否”) 理由是
装置[Ⅲ]是否可行(填“是”或“否”) 理由是 .
①用
②用0.1000mol?L-1KMnO4溶液滴定,MnO
- 4 |
(2)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ].并设想用装置[Ⅱ]或装置[Ⅲ]两种简易装置代替装置[Ⅰ]的b~c部分,以求达到同样的目的.

试回答:
①若用装置[Ⅰ]制取氯气,b瓶加入的液体一般为
②装置[Ⅰ]中b能防止多余气体逸散的原因是:
③欲用装置[Ⅱ]或装置[Ⅲ]代替装置[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由.
装置[Ⅱ]是否可行(填“是”或“否”)
装置[Ⅲ]是否可行(填“是”或“否”)
分析:(1)①过氧化氢是强氧化剂腐蚀橡胶管,不能选择碱式滴定管,而选择酸式滴定管;
②过氧化氢做还原剂被氧化为氧气,高锰酸钾被还原为锰离子,依据电子守恒和原子守恒配平写出;反应终点判断利用高锰酸钾溶液是紫色溶液进行分析判断;
③依据离子方程式定量关系计算过氧化氢物质的量得到质量来计算质量分数;
(2)①发生装置是制备氯气,气体中含有氯化氢,需要用饱和食盐水除去;当关闭活塞K时如若发现c中液面上升不明显可能是装置漏气造成,检查的方法可以依据氯气使湿润的淀粉碘化钾试纸变蓝分析判断;
②利用装置的储气功能分析;
③分析装置Ⅱ可知,关闭活塞K,气体压强增大,液体被压入c中起到储气的作用;分析装置Ⅲc装置密闭,b中液体不能排入装置c;
②过氧化氢做还原剂被氧化为氧气,高锰酸钾被还原为锰离子,依据电子守恒和原子守恒配平写出;反应终点判断利用高锰酸钾溶液是紫色溶液进行分析判断;
③依据离子方程式定量关系计算过氧化氢物质的量得到质量来计算质量分数;
(2)①发生装置是制备氯气,气体中含有氯化氢,需要用饱和食盐水除去;当关闭活塞K时如若发现c中液面上升不明显可能是装置漏气造成,检查的方法可以依据氯气使湿润的淀粉碘化钾试纸变蓝分析判断;
②利用装置的储气功能分析;
③分析装置Ⅱ可知,关闭活塞K,气体压强增大,液体被压入c中起到储气的作用;分析装置Ⅲc装置密闭,b中液体不能排入装置c;
解答:解:(1)①量取5.00mL H2O2溶液(密度为1.00g?mL-1)置于锥形瓶中,过氧化氢是强氧化剂腐蚀橡胶管,不能选择碱式滴定管,而选择酸式滴定管;
故答案为:酸式滴定管;
②过氧化氢做还原剂被氧化为氧气,高锰酸钾被还原为锰离子,依据电子守恒和原子守恒配平写出反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;反应终点判断利用高锰酸钾溶液是紫色溶液进行分析判断,当加入最后一滴KMnO4溶液,溶液出现紫色且半分钟不再变化,说明达到滴定终点;
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;加入最后一滴KMnO4溶液,溶液出现紫色且半分钟不再变化,说明达到滴定终点;
③0.1000mol?L-1KMnO4溶液,消耗的KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,平均消耗体积=
=20ml,依据离子方程式定量关系计算过氧化氢物质的量,n(MnO4-)=0.1000mol/L×0.0200L=2×10-3mol,依据定量关系2MnO4-~5H2O2,得到过氧化氢物质的量=
×2×10-3mol=5×10-3mol,过氧化氢的质量分数=
×100%=3.4%;
g故答案为:3.4%;
(2)①发生装置是制备氯气,气体中含有氯化氢,需要用饱和食盐水除去;当关闭活塞K时如若发现c中液面上升不明显可能是装置漏气造成,检查的方法可以依据氯气使湿润的淀粉碘化钾试纸变蓝分析判断;
故答案为:饱和食盐水,装置漏气,用湿润的淀粉碘化钾试纸,靠近各接口处检验,漏气处试纸变蓝;
②利用装置的储气功能分析,装置[Ⅰ]中b能防止多余气体逸散的原因是关闭活塞后若a中仍有气体生成,气体压强增大,将b中液体压入c中,整个装置成为储气装置;
故答案为:关闭活塞后若a中仍有气体生成,气体压强增大,将b中液体压入c中,整个装置成为储气装置;
③分析装置Ⅱ可知,关闭活塞K,气体压强增大,液体被压入c中起到储气的作用;分析装置Ⅲc装置密闭,b中液体不能排入装置c;
故答案为:是,原理与装置Ⅰ相同,关闭活塞K,气体压强增大,整个装置成为储气装置;否,c瓶因密闭,体积不能改变,压强增大时有危险;
故答案为:酸式滴定管;
②过氧化氢做还原剂被氧化为氧气,高锰酸钾被还原为锰离子,依据电子守恒和原子守恒配平写出反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;反应终点判断利用高锰酸钾溶液是紫色溶液进行分析判断,当加入最后一滴KMnO4溶液,溶液出现紫色且半分钟不再变化,说明达到滴定终点;
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;加入最后一滴KMnO4溶液,溶液出现紫色且半分钟不再变化,说明达到滴定终点;
③0.1000mol?L-1KMnO4溶液,消耗的KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,平均消耗体积=
| 20.00ml+19.98ml+20.02ml |
| 3 |
| 5 |
| 2 |
| 5×10-3mol×34g/mol |
| 5.00ml×1.00g/ml |
g故答案为:3.4%;
(2)①发生装置是制备氯气,气体中含有氯化氢,需要用饱和食盐水除去;当关闭活塞K时如若发现c中液面上升不明显可能是装置漏气造成,检查的方法可以依据氯气使湿润的淀粉碘化钾试纸变蓝分析判断;
故答案为:饱和食盐水,装置漏气,用湿润的淀粉碘化钾试纸,靠近各接口处检验,漏气处试纸变蓝;
②利用装置的储气功能分析,装置[Ⅰ]中b能防止多余气体逸散的原因是关闭活塞后若a中仍有气体生成,气体压强增大,将b中液体压入c中,整个装置成为储气装置;
故答案为:关闭活塞后若a中仍有气体生成,气体压强增大,将b中液体压入c中,整个装置成为储气装置;
③分析装置Ⅱ可知,关闭活塞K,气体压强增大,液体被压入c中起到储气的作用;分析装置Ⅲc装置密闭,b中液体不能排入装置c;
故答案为:是,原理与装置Ⅰ相同,关闭活塞K,气体压强增大,整个装置成为储气装置;否,c瓶因密闭,体积不能改变,压强增大时有危险;
点评:本题考查了物质性质的实验分析判断,中和滴定的实验操作分析应用,注意装置中导气管的作用和气体压强的变化分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
 通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:
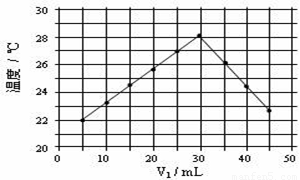
通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验: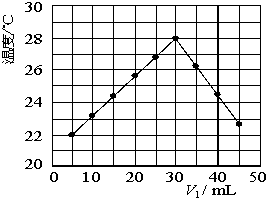 某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题:
某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题: 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.