题目内容
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
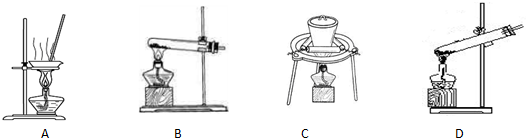
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。

A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
|
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察 |
现象:溶液中产生大量白色沉淀;
结论: 。 |
|
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察 |
现象: ; 结论:样品中含有NaHCO3 。 |
|
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 |
现象: ; 结论: 。 |
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
② 加少许淀粉溶液,用c mol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当 ,达到滴定终点。
③ 重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度: mg/L(Cl的相对原子质量:35.5)
(16分)
(1) NaCl + NH3 + CO2 + H2O = NaHCO3 ↓+ NH4Cl (2分,没有沉淀符号扣1分)
(2)BC (2分)
(3)
|
步骤一:取少量制品于试管中,加入少量蒸馏水,振荡,溶解:往试管中加入 过量的Ba(NO3)2溶液,振荡,观察 (2分) |
现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3 。(1分) |
|
步骤二:将步骤一的浊液过滤:取滤液于试管B中,加入 适量的NaOH溶液, 振荡,观察(1分) |
现象:有少量白色沉淀生成 ;(1分) 结论:试样中含有NaHCO3 。 |
|
步骤三: 将步骤二的浊液过滤后,取滤液于试管C中,先加入足量的稀硝酸,再加入少许AgNO3溶液,振荡,观察(2分) |
现象:有少量白色沉淀生成 ; 结论:试样中含有NaCl 。(1分) |
(8分)检验出Na2CO3 得3分;检验出NaHCO3 得2分(若用硝酸检验得1分),
检验出NaCl得3分(未加过量硝酸不得分)。三种物质检验不诛连。
(4)② 最后一滴溶液滴入,锥形瓶内的液体恰好从蓝色变成无色,且半分钟不变化 (2分)
③ 177.5 cV (即:0.5×c×V×10-3×71×1000/0.2)(2分)
【解析】
试题分析:(1)氨气易溶于饱和食盐水,且NH3+H2O=NH3•H2O,得到氯化钠、氨水溶液;一水合氨是弱碱,二氧化碳是酸性氧化物,不断通入二氧化碳气体时,NH3•H2O+CO2=NH4HCO3;由于碳酸氢钠的溶解度比氯化钠、碳酸氢铵都小,碳酸氢钠最先达到饱和,则碳酸氢铵与氯化钠容易反应,生成碳酸氢钠晶体和氯化铵溶液,即NH4HCO3+NaCl=NaHCO3↓+NH4Cl;上述几步反应加起来可得:NaCl + NH3 + CO2 + H2O = NaHCO3 ↓+ NH4Cl;(2)碳酸氢钠是固体,加热固体样品应该选择试管或坩埚,故BC正确;A项,属于蒸发装置,加热盐溶液,分离和盐和水,故A错;未了防止冷凝水回流时,导致热的试管底突然遇冷炸裂,试管底应该略低于试管口,故D错;(3)制品是碳酸钠、碳酸氢钠和氯化钠组成的混合物,它们都是可溶性盐,根据实验步骤一、二、三的操作及预期现象和结论综合推断,步骤I加入的试剂是过量或足量Ba(NO3)2溶液,振荡,因为硝酸钡只能与碳酸钠反应,生成碳酸钡沉淀和硝酸钠,可以检验制品中含有碳酸钠,并且除去其中的碳酸钠,防止碳酸钠对碳酸氢钠、氯化钠的检验产生干扰;由于碳酸氢钠与硝酸钡不能反应,但是碳酸氢钠与足量或过量氢氧化钠能发生反应,生成水和碳酸钠,生成物中的碳酸钠与步骤一中加入的过量或足量的硝酸钡反应,滤液中又产生少量的白色沉淀,说明制品中含有少量碳酸氢钠;检验制品中的氯化钠可以用硝酸银溶液检验,但是碳酸钠也能与硝酸银反应,都产生白色沉淀,因此需要除去制品中的碳酸钠,由于步骤二的滤液中含有过量氢氧化钠,氢氧化钠也能与硝酸银反应,产生白色沉淀,对氯化钠的检验造成干扰,则步骤三必须先用过量或足量稀硝酸酸化,中和氢氧化钠之后,再向步骤二的滤液中滴入少量或几滴AgNO3溶液,产生少量的白色沉淀,说明制品中含有氯化钠;(4)实验①中发生的反应为Cl2+2I-=2Cl-+ I2,则锥形瓶内溶液中的碘离子被自来水中的氯气氧化为单质碘;单质碘遇淀粉变蓝,则实验②中发生的反应为I2+2S2O32-=2I-+S4O62-,碘离子遇淀粉不变色,则锥形瓶内溶液的颜色由蓝色变为无色,说以滴定终点的现象为:最后一滴Na2S2O3溶液溶液滴入,锥形瓶内的液体恰好从蓝色变成无色,且半分钟不变化;先根据c•V=n求Na2S2O3溶液中溶质的物质的量,即n(Na2S2O3)=cmol/L×V×10-3L= c×V×10-3mol;由于Na2S2O3是强电解质,完全电离出钠离子和硫代硫酸根离子,且n(S2O32-)= n(Na2S2O3)= c×V×10-3mol;由于I2+2S2O32-=2I-+S4O62-中I2与S2O32-的物质的量之比等于系数之比,则单质的物质的量为c×V×10-3mol×1/2;由于Cl2+2I-=2Cl-+ I2中Cl2与I2的物质的量之比等于系数之比,则自来水中氯气的物质的量为c×V×10-3mol×1/2×1/1; 氯气的相对分子质量为71,然后根据n•M=m求自来水中所含氯气的质量,则m(Cl2)= c×V×10-3mol×1/2×1/1×71g/mol;200mL=0.2L,最后根据n/V=c求自来水中所含氯气的浓度,则c(Cl2)= c×V×10-3mol×1/2×1/1×71g/mol÷0.2L=0.5×c×V×10-3×71/0.2g/L=0.5×c×V×10-3×71×1000/0.2mg/L= 177.5 cV mg/L,因为1g=1000mg。
考点:考查探究实验,涉及碳酸钠工业制法的化学方程式、加热固体的方法及使用的仪器、设计实验方案检验制品中的碳酸钠、设计实验方案检验制品中的碳酸氢钠、设计实验方案检验制品中的氯化钠、定量检测自来水中所含氯气的原理、滴定终点的现象、物质的量在电离或离子方程式中的应用、物质的量浓度、消耗标准溶液的体积、摩尔质量、质量、指定情况下的浓度等。

 快捷英语周周练系列答案
快捷英语周周练系列答案