题目内容
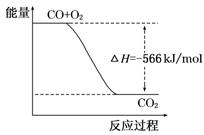
已知:2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+
 ΔH="-226" kJ/mol
ΔH="-226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )

A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
【答案】
C
【解析】
试题分析:燃烧热的单位是kJ/mol,A不正确;B不正确,图中的量标明错误,应标为2molCO和2molCO2。CO2气体的能量大于固体的能量,故C项中放出的能量应小于452KJ。由于比较反应热时要带着符号比较,所以△H>-452KJ/mol,C正确;D选项中根据盖斯定律可知,将下式乘以2,然后与上式相加,再除以2,即得CO与Na2O2的反应热,即Na2O2(s)+CO(g)=Na2CO3(s) ΔH=-509kJ/mol,反应中转移2个电子,D不正确,答案选C。
考点:考查反应热判断、计算以及氧化还原反应的计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力对培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。

练习册系列答案
相关题目