题目内容
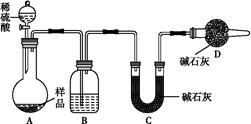
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是____________________________________。
(2)将MnO4-氧化Fe2+的离子方程式补充完整: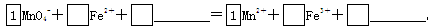
(3)已知:
生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:________。
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是__________。
②Ⅳ 中加入MnSO4的目的是_____________________________________________。
(1)Al2O3+6H+=2Al3++3H2O
(2)5 8H+ 5 4H2O
(3)pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)①生成黄绿色气体 ②除去过量的MnO4-
解析

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O =" 4NaOH" + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
[实验与判断] 请完成下列表格:
| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 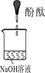 | 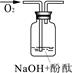 | 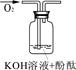 |
| 验证猜想 | | C | |
| 实验现象 | 溶液变红后不退色 | ||
| 实验说明 | 1、2的实验中NaOH溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 | ||
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。
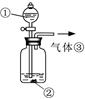
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。
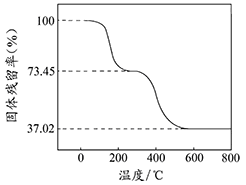
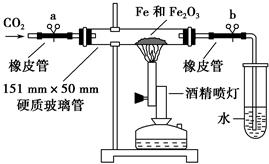
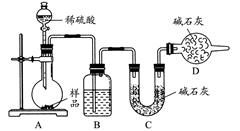
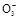
 BaCO3↓+H2O)
BaCO3↓+H2O)