题目内容
已知NO2和N2O4可以相互转化: N2O4 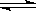 2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s
(2)在4s时容器内的压强为开始时的 倍
(3)在平衡时容器内含N2O4 mol
(4)在平衡时容器内NO2的浓度为 mol/L
(5)平衡时N2O4的转化率为
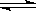 2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s
(2)在4s时容器内的压强为开始时的 倍
(3)在平衡时容器内含N2O4 mol
(4)在平衡时容器内NO2的浓度为 mol/L
(5)平衡时N2O4的转化率为
(1)0.005mol/(L·s)(2)1.2倍(3)0.2mol(4)0.16mol/L (5)80%
试题分析:N2O4
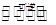 2 NO2
2 NO2(1)反应进行4s时NO2的浓度为0.04mol/L;则v(NO2)="0.04mol/L" / 4s="0.04mol/(L·s)" ;v(N2O4)/v(NO2)=1/2,故前4秒以N2O4浓度变化表示的平均反应速率为0.005mol/(L·s)
(2)等温等容,压强与气体的物质的量成正比。则4秒时,n(NO2)="0.04mol/L" * 10L = 0.4mol
参加反应的N2O4为0.2mol,则此时容器内气体总物质的量为1mol-0.2mol+0.4mol=1.2mol,起始是容器中只有1mol N2O4气体,则在4s时容器内的压强为开始时的1.2倍;
(3)平衡时压强为开始的1.8倍,则平衡时容器内气体物质的量为1.8mol,设参加反应的N2O4为x,则有(1-x)+2x=1.8 解得:x=0.8mol,则在平衡时容器内含N2O4 的物质的量为:1mol-0.8mol=0.2mol;
(4)由于在平衡时容器内含N2O4 0.8mol,故此时容器内NO2的浓度为(0.8*2)/10 mol/L =0.16mol/L,则在平衡时容器内NO2的浓度为0.16mol/L;
(5)平衡时消耗的N2O4物质的量为:0.8mol ,则平衡时N2O4的转化率为:0.8mol/1mol=80% ;
点评:化学反应速率为高考重要考点之一,基础演算能力的要求较高,而且全面要求考生对可逆反应、化学反应速率等相关知识的理解与熟练掌握,具有一定的分析力度与考查难度,考生平时应当多注重化学反应速率相关内容的实践练习。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
 CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1 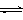 CH3OH(g)+H2O(g) ,
CH3OH(g)+H2O(g) ,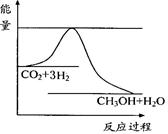
 2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是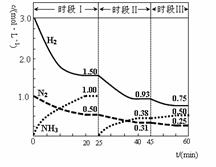
 Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为
Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为 xC(g)+2D(g),在a min后,容器中c(A)=0. 1 mol·L-1,则a min内,v(B)=______ ______;若温度不变,压强变为0.9p,则v(C)=____ ___,x=_________。
xC(g)+2D(g),在a min后,容器中c(A)=0. 1 mol·L-1,则a min内,v(B)=______ ______;若温度不变,压强变为0.9p,则v(C)=____ ___,x=_________。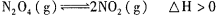 ,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是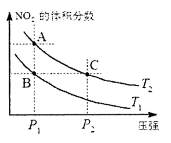
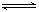 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是 2C(g);△H<0,①容器容积固定,外有隔热套 ②容器容积固定 ③容器有活塞可移动。下列说法正确的是
2C(g);△H<0,①容器容积固定,外有隔热套 ②容器容积固定 ③容器有活塞可移动。下列说法正确的是