题目内容
(2007?福田区模拟)850℃时反应A(g)+B(g) C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(mol?L-1)变化
C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(mol?L-1)变化
(1)计算t℃该化学反应的平衡常数:
(2)t℃
(3)反应在4min~5min之间,平衡
a.增加A的浓度 b.增加D的浓度 c.加压 d.使用催化剂
(4)某温度下反应C(g)+D(g)?A(g)+B(g)的平衡浓度符合c(C)?c(D)=2c(A)?c(B),则此时的温度
 C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(mol?L-1)变化
C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(mol?L-1)变化| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
| 1 |
| 2 |
| 1 |
| 2 |
(2)t℃
大于
大于
850℃(填大于、小于或等于).判断依据是反应放热,温度升高平衡向逆反应方向移动,平衡常数减小
反应放热,温度升高平衡向逆反应方向移动,平衡常数减小
(3)反应在4min~5min之间,平衡
向左
向左
(填“向左”、“向右”或“不”)移动,可能的原因是b
b
a.增加A的浓度 b.增加D的浓度 c.加压 d.使用催化剂
(4)某温度下反应C(g)+D(g)?A(g)+B(g)的平衡浓度符合c(C)?c(D)=2c(A)?c(B),则此时的温度
大于
大于
850℃(填大于、小于或等于).分析:850℃时平衡常数K=l,
由表中数据可知,反应进行到3min时,达到平衡状态,此时k=
=
,
反应在4min~5min之间,A、B浓度比3min时大,而C的浓度比3min时小,说明平衡向逆反应方向移动,
A(g)+B(g) C(g)+D(g)△H<0,
C(g)+D(g)△H<0,
则C(g)+D(g)?A(g)+B(g)△H>0,升高温度平衡向正反应方向移动,850℃时平衡常数K=l,
某温度下平衡浓度符合c(C)?c(D)=2c(A)?c(B),则k=2,说明温度大于850℃.
由表中数据可知,反应进行到3min时,达到平衡状态,此时k=
| 0.100×0.100 |
| 0.100×0.200 |
| 1 |
| 2 |
反应在4min~5min之间,A、B浓度比3min时大,而C的浓度比3min时小,说明平衡向逆反应方向移动,
A(g)+B(g)
 C(g)+D(g)△H<0,
C(g)+D(g)△H<0,则C(g)+D(g)?A(g)+B(g)△H>0,升高温度平衡向正反应方向移动,850℃时平衡常数K=l,
某温度下平衡浓度符合c(C)?c(D)=2c(A)?c(B),则k=2,说明温度大于850℃.
解答:解:(1)由表中数据可知,反应进行到3min时,达到平衡状态,此时k=
=
,
故答案为:
;
(2)反应放热,温度升高平衡向逆反应方向移动,平衡常数减小,则t℃大于850℃,
故答案为:大于;反应放热,温度升高平衡向逆反应方向移动,平衡常数减小;
(3)反应在4min~5min之间,A、B浓度比3min时大,而C的浓度比3min时小,说明平衡向逆反应方向移动,
可能原因应为增加D的浓度,而增大压强或加入催化剂平衡都不移动,
故答案为:向左;b;
(4)A(g)+B(g) C(g)+D(g)△H<0,
C(g)+D(g)△H<0,
则C(g)+D(g)?A(g)+B(g)△H>0,升高温度平衡向正反应方向移动,850℃时平衡常数K=l,
某温度下平衡浓度符合c(C)?c(D)=2c(A)?c(B),则k=2,说明温度大于850℃,
故答案为:大于.
| 0.100×0.100 |
| 0.100×0.200 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
(2)反应放热,温度升高平衡向逆反应方向移动,平衡常数减小,则t℃大于850℃,
故答案为:大于;反应放热,温度升高平衡向逆反应方向移动,平衡常数减小;
(3)反应在4min~5min之间,A、B浓度比3min时大,而C的浓度比3min时小,说明平衡向逆反应方向移动,
可能原因应为增加D的浓度,而增大压强或加入催化剂平衡都不移动,
故答案为:向左;b;
(4)A(g)+B(g)
 C(g)+D(g)△H<0,
C(g)+D(g)△H<0,则C(g)+D(g)?A(g)+B(g)△H>0,升高温度平衡向正反应方向移动,850℃时平衡常数K=l,
某温度下平衡浓度符合c(C)?c(D)=2c(A)?c(B),则k=2,说明温度大于850℃,
故答案为:大于.
点评:本题考查化学平衡移动以及化学平衡常数的计算,题目难度中等,本题注意把握平衡常数的意义,答题中注意化学平衡常数的变化与温度的关系.

练习册系列答案
相关题目
 (2007?福田区模拟)如图中曲线表示原子序数在前20号中的某些元素的原子序数(按递增顺序连续排列)和单质沸点的关系,其中A点表示的元素是( )
(2007?福田区模拟)如图中曲线表示原子序数在前20号中的某些元素的原子序数(按递增顺序连续排列)和单质沸点的关系,其中A点表示的元素是( )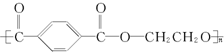 (2007?福田区模拟)奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维(结构如下),下列说法不正确的是( )
(2007?福田区模拟)奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维(结构如下),下列说法不正确的是( )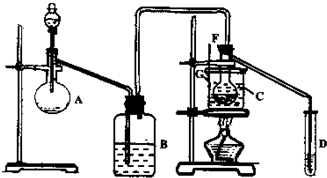 (2007?福田区模拟)某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右).但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种.现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
(2007?福田区模拟)某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右).但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种.现选用块状电石、浓H2SO4、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题: