题目内容
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2
0.2 mol·L一1,H2
0.8 mol·L一1,CH40.8
mol·L一1,H2O1.6
mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2
0.2 mol·L一1,H2
0.8 mol·L一1,CH40.8
mol·L一1,H2O1.6
mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如
图所示:

①上述生产过程的能量转化方式是____________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___________________。
(1)①2;②+18.7 kJ·mol-1(2)80%;25;<
(3)①太阳能和电能转化为化学能;②2CO32--4e-=2CO2↑+O2↑
【解析】
试题分析:(1)①由6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)知,反应方程式FeO中铁元素化合价+2升至Fe3O4中+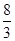 ,CO2由+4降至C中碳元素的0价,每生成1molC转移电子4mol,生成Fe3O4 2mol ,则生成1 mol Fe3O4转移电子2mol;②反应1:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s),△H1=-76.0
kJ/mol;反应2:C(s)+2H2O(g)=CO2(g)+2H2(g),△H2=+113.4
kJ/mol,根据盖斯定理△H=
,CO2由+4降至C中碳元素的0价,每生成1molC转移电子4mol,生成Fe3O4 2mol ,则生成1 mol Fe3O4转移电子2mol;②反应1:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s),△H1=-76.0
kJ/mol;反应2:C(s)+2H2O(g)=CO2(g)+2H2(g),△H2=+113.4
kJ/mol,根据盖斯定理△H= (△H1+△H2)=
(△H1+△H2)= (-76.0+113.4)=+18.7 kJ/mol(2)2 L的恒容密闭容器中反应达到平衡时CH4浓度为0.8 mol/L,CO2浓度为0.2 mol/L,由题意知CO2(g)+4H2(g)
(-76.0+113.4)=+18.7 kJ/mol(2)2 L的恒容密闭容器中反应达到平衡时CH4浓度为0.8 mol/L,CO2浓度为0.2 mol/L,由题意知CO2(g)+4H2(g) CH4(g)+2H2O(g),反应的CO2与生成的CH4的物质量相等,CO2的平衡转化率为
CH4(g)+2H2O(g),反应的CO2与生成的CH4的物质量相等,CO2的平衡转化率为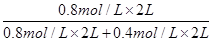 =
=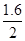 =80%;300 ℃时上述反应的平衡常数K=
=80%;300 ℃时上述反应的平衡常数K=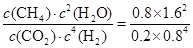 =25;由题意知300 ℃时,K=25,200℃时,K=64.8,对正反应为吸热的可逆反应,升高温度,平衡正向移动,正反应的程度增大,K增大,对正反应为放热的可逆反应,升高温度,平衡逆向移动,正反应的程度减小,K减小,则该反应为放热反应,△H<0(3)由图知,是用吸收的太阳能和电源电能进行反应能量的来源,故太阳能和电能转化为化学能;电解反应中阳极失电子发生氧化反应,由图知反应产物为O2,又电解质为熔融碳酸钠,故反应方程式:2CO32--4e-=2CO2↑+O2↑。
=25;由题意知300 ℃时,K=25,200℃时,K=64.8,对正反应为吸热的可逆反应,升高温度,平衡正向移动,正反应的程度增大,K增大,对正反应为放热的可逆反应,升高温度,平衡逆向移动,正反应的程度减小,K减小,则该反应为放热反应,△H<0(3)由图知,是用吸收的太阳能和电源电能进行反应能量的来源,故太阳能和电能转化为化学能;电解反应中阳极失电子发生氧化反应,由图知反应产物为O2,又电解质为熔融碳酸钠,故反应方程式:2CO32--4e-=2CO2↑+O2↑。
考点:电子守恒;盖斯定理的计算;反应平衡常数的计算;反应热与焓变;电解原理

 CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0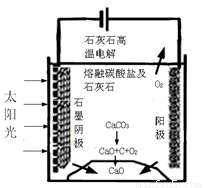
 CH4(g)+2H2O(g)
ΔH<0
CH4(g)+2H2O(g)
ΔH<0
 )不稳定,请写出环氧乙烷(
)不稳定,请写出环氧乙烷( )与CO2通过加聚制造全降解塑料的化学方程式:_________________________。
)与CO2通过加聚制造全降解塑料的化学方程式:_________________________。