题目内容
在25℃下,将a mol?L-1的醋酸(HAc)与0.01mol?L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na*)=c(Ac-).则下列说法中,不正确的是( )A.此时醋酸和氢氧化钠溶液恰好中和
B.反应平衡时溶液显中性
C.用含a的代数式表示醋酸(HAc)的电离常数为Ka=
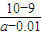 mol?L-1
mol?L-1D.a肯定大于0.01
【答案】分析:A、醋酸是弱酸与氢氧化钠反应恰好反应时生成的醋酸钠水解显碱性;
B、依据溶液中电荷守恒分析判断;
C、依据电荷守恒得到氢离子浓度和氢氧根离子浓度相同,常温下为10-7mol/L,醋酸的平衡常数只随温度变化,所以根据反应后的溶液中醋酸电离常数计算即可;
D、若a≤0.01,则醋酸和氢氧化钠恰好反应生成醋酸钠和水或氢氧化钠过量,溶液显碱性,若a大于0.01,反应后溶液可能成中性;
解答:解:在25℃下,将a mol?L-1的醋酸(HAc)与0.01mol?L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na*)=c(Ac-).依据溶液中电荷守恒[Na+]+[H+]=[OH-]+[Ac-],反应后的溶液呈中性,[H+]=[OH-]=10-7mol/L;
A、醋酸是弱酸,与氢氧化钠反应恰好反应时生成的醋酸钠水解显碱性,所以上述溶液是酸过量,故A错误;
B、反应平衡时溶液中c(Na*)=c(Ac-).依据溶液中电荷守恒[Na+]+[H+]=[OH-]+[Ac-],反应后的溶液呈中性,[H+]=[OH-],所以溶液呈中性,故B正确;
C、反应平衡时溶液中c(Na*)=c(Ac-).依据溶液中电荷守恒[Na+]+[H+]=[OH-]+[Ac-],反应后的溶液呈中性,[H+]=[OH-]=10-7mol/L;假设醋酸和氢氧化钠体积为1L,得到n(Na+)=0.01mol,n(HAc)=amol,反应后溶液中醋酸的电离常数K=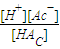 =
=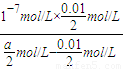 =
=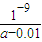 mol/L,故C正确;
mol/L,故C正确;
D、若a≤0.01,则醋酸和氢氧化钠恰好反应生成醋酸钠和水或氢氧化钠过量,溶液显碱性,若a大于0.01,反应后溶液可能成中性;故D正确;
故选A.
点评:本题考查了酸碱反应后溶液酸碱性的判断,溶液中电荷守恒的应用,弱电解质电离平衡常数的计算和影响条件,题目综合性较强,需要准确掌握有关弱电解质的性质,关键是电离平衡常数的计算和理解.
B、依据溶液中电荷守恒分析判断;
C、依据电荷守恒得到氢离子浓度和氢氧根离子浓度相同,常温下为10-7mol/L,醋酸的平衡常数只随温度变化,所以根据反应后的溶液中醋酸电离常数计算即可;
D、若a≤0.01,则醋酸和氢氧化钠恰好反应生成醋酸钠和水或氢氧化钠过量,溶液显碱性,若a大于0.01,反应后溶液可能成中性;
解答:解:在25℃下,将a mol?L-1的醋酸(HAc)与0.01mol?L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na*)=c(Ac-).依据溶液中电荷守恒[Na+]+[H+]=[OH-]+[Ac-],反应后的溶液呈中性,[H+]=[OH-]=10-7mol/L;
A、醋酸是弱酸,与氢氧化钠反应恰好反应时生成的醋酸钠水解显碱性,所以上述溶液是酸过量,故A错误;
B、反应平衡时溶液中c(Na*)=c(Ac-).依据溶液中电荷守恒[Na+]+[H+]=[OH-]+[Ac-],反应后的溶液呈中性,[H+]=[OH-],所以溶液呈中性,故B正确;
C、反应平衡时溶液中c(Na*)=c(Ac-).依据溶液中电荷守恒[Na+]+[H+]=[OH-]+[Ac-],反应后的溶液呈中性,[H+]=[OH-]=10-7mol/L;假设醋酸和氢氧化钠体积为1L,得到n(Na+)=0.01mol,n(HAc)=amol,反应后溶液中醋酸的电离常数K=
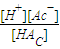 =
=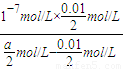 =
=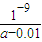 mol/L,故C正确;
mol/L,故C正确;D、若a≤0.01,则醋酸和氢氧化钠恰好反应生成醋酸钠和水或氢氧化钠过量,溶液显碱性,若a大于0.01,反应后溶液可能成中性;故D正确;
故选A.
点评:本题考查了酸碱反应后溶液酸碱性的判断,溶液中电荷守恒的应用,弱电解质电离平衡常数的计算和影响条件,题目综合性较强,需要准确掌握有关弱电解质的性质,关键是电离平衡常数的计算和理解.

练习册系列答案
相关题目
经长期实践,人们总结出反应速率和反应物浓度之间存在定量关系:恒温下,对简单反应来说,化学反应速率同反应物浓度的方次的乘积成正比(反应物浓度的方次等于反应方程式中各物质的化学计量数)。如对于反应mA+nB![]() C来说,v=kc(A)m·c(B)n,其中k为常数。
C来说,v=kc(A)m·c(B)n,其中k为常数。
思考:今有一反应aA+bB![]() C,在25 ℃时,将A、B溶液按不同浓度混合,得到下列实验数据:
C,在25 ℃时,将A、B溶液按不同浓度混合,得到下列实验数据:
A的浓度mol·L-1 | B的浓度mol·L-1 | 反应速率vmol·L-1·s-1 |
1.0 | 1.0 | 1.2×10-2 |
1.0 | 4.0 | 1.92×10-1 |
4.0 | 1.0 | 4.8×10-2 |
分析以上数据,求出a、b的值。
经过长期实践,人们总结出反应速率和反应物浓度间的定量关系:在恒温下,对简单反应来说,化学反应速率同反应物浓度方次乘积成正比(反应物浓度的方次,等于反应式中各化学式前的化学计量数)。如:对于反应式mA+Nb====C,v=K[A]m·[B]m(其中K为常数)。
今有一反应aA+bB====C,在25 ℃时,将A、B溶液按不同浓度混合,得下列实验数据:
| A的浓度/mol·L-1 | B的浓度/mol·L-1 | 反应速率/mol·L-1·s-1 |
| 1.0 | 1.0 | 1.2×10-2 |
| 1.0 | 4.0 | 1.92×10-1 |
| 4.0 | 1.0 | 4.8×10-2 |
分析以上数据,求出a、b的值:a=_________________,b=_________________。