题目内容
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加
热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
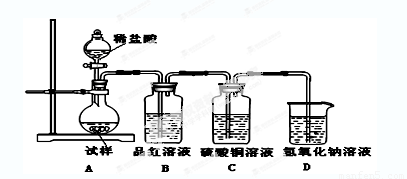
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠
和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至
足量,在滴加稀盐酸的整个过程中 的物质的量浓度变化趋势为 ;
的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加足量盐酸后,烧瓶内除 外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀 ,再加
,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
(4)写出 固体加热到600℃以上分解的化学方程式
。
固体加热到600℃以上分解的化学方程式
。
(1)先逐渐增大,后逐渐减小 (2分)
(2) (2分);
(2分);
B中品红溶液褪色,C中无明显变化或有气泡(2分,或答“B中无明显变化或有气泡,C中产生黑色沉淀”,但 答“B中品红溶液褪色,C中产生黑色沉淀”不得分,)
(3)乙(1分);甲中先加入具有强氧化性的稀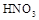 ,它能将
,它能将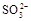 氧化成
氧化成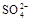 ,不能判定是否生成
,不能判定是否生成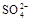 (2分)。
(2分)。
(4)4Na2SO3 Na2S +3Na2SO4(2分)
Na2S +3Na2SO4(2分)
【解析】
试题分析:(1)加热温度低于600℃,亚硫酸钠没有分解,加入稀盐酸反应分步进行,SO32-+H+=HSO3-
HSO3-+H+=SO2↑+H2O,故浓度先逐渐增大,后减少;(2)亚硫酸钠受热分解,发生氧化还原反应,反应方程式为4Na2SO3 = Na2S
+3Na2SO4,加入盐酸出现的黄色固体应为S单质,是酸性条件下的SO32-和S2-的归中反应。产生的气体应有SO2和H2S,但二者不共存,故最终产生的气体只能是其中一种,现象为B中品红溶液褪色,C中无明显变化或有气泡(气体为SO2)或B中无明显变化或有气泡,C中产生黑色沉淀(气体为H2S);(3)甲中先加入具有强氧化性的稀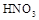 ,它能将
,它能将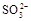 氧化成
氧化成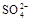 ,不能判定是否生成
,不能判定是否生成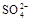 .。
.。
考点:考查化学实验有关问题。

 习题精选系列答案
习题精选系列答案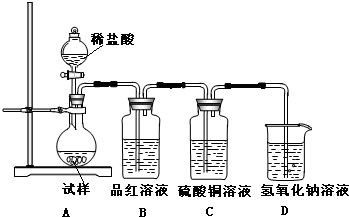 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
