题目内容
下列物质中,属于强电解质的是
A.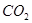 | B.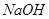 溶液 溶液 | C. | D.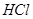 |
D
解析试题分析:A.CO2是非电解质,错误;B.NaOH溶液是混合物,不是纯净物,无谓电解质与非电解质,错误;C.NH3·H2O在水中能够微弱的电离产生铵根离子和氢氧根离子,是弱电解质,错误;D.HCl在水中能够完全电离产生H+和Cl-。是强电解质,正确。
考点:考查电解质的分类的知识。

练习册系列答案
相关题目
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是 ( )
A.NH NO NO CO CO Na+ Na+ | B.Na+ Ba2+ Mg2+ HCO |
C.NO K+ AlO K+ AlO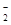 OH- OH- | D.NO Mg2+ K+ Cl- Mg2+ K+ Cl- |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.能使淀粉-KI试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- |
| B.含有0.1mol·L-1Fe2+的溶液:Na+、ClO-、SO42-、Cl- |
| C.c(H+)/c(OH-)=1012的溶液中:Al3+、NH4+、NO3-、K+ |
| D.含有0.1mol·L-1HCO3-的溶液:Na+、Fe3+、NO3-、SO42- |
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是
| A.NH4+、K+、Cl-、OH- | B.H+、Fe2+、MnO4-、Cl- |
| C.Ba2+、Na+、NO3-、SO42- | D.Na+、H+、CO32-、SO42- |
下列有关表述正确的是
| A.加入催化剂不会使化学平衡移动 |
| B.把封有NO2的烧瓶浸入热水中,颜色变浅 |
| C.用30%的FeCl3溶液腐蚀印刷线路板上的铜箔:Fe3+ + Cu=Fe2+ + Cu2+ |
| D.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
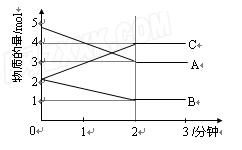
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)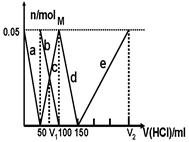
| A.M点时生成的CO2为0 mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓ |
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。为分析其组成,现进行如下实验:
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解。
则下列说法正确的是
| A.仅由实验①可推出肯定含有SO42-,不含Cl- |
| B.该无色溶液肯定含有NH4+、K+、Al3+、SO42- |
| C.该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- |
| D.不能确定该无色溶液是否含有K+ |
下列说法正确的是( )
| A.强电解质溶液一定比弱电解质溶液的导电性强 |
| B.强电解质的水溶液中不存在电解质分子 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.不同的弱电解质只要物质的量浓度相同,电离程度也就相同 |