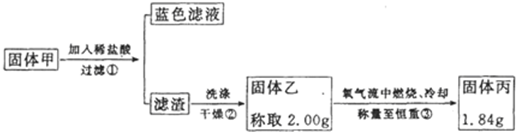
题目内容
(2012?长沙模拟)在25℃101kPa下,①2Na(s)+
O2(g)═Na2O(s)△H1=-414kJ/mol,
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol,
下列说法正确的是( )
| 1 |
| 2 |
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol,
下列说法正确的是( )
分析:A、Na2O中阴阳离子个数之比为1:2,Na2O2中阴阳离子个数之比为1:2;
B、由钠原子的个数及钠元素的化合价分析转移的电子数;
C、钠与氧气在加热时生成过氧化钠,温度越高,反应速率越大;
D、利用已知的两个反应和盖斯定律来分析.
B、由钠原子的个数及钠元素的化合价分析转移的电子数;
C、钠与氧气在加热时生成过氧化钠,温度越高,反应速率越大;
D、利用已知的两个反应和盖斯定律来分析.
解答:解:A、在Na2O中阳离子是钠离子、阴离子是氧离子,Na2O2中阳离子是钠离子、阴离子是过氧根离子,因此阴、阳离子的个数比都是1:2,①和②产物的阴阳离子个数比相等,故A错误;
B、由钠原子守恒可知,①和②生成等物质的量的产物时,钠元素的化合价都是由0升高到+1价,则转移的电子数相同,故B错误;
C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O2,且速率逐渐加快,故C错误;
D、热化学方程式25℃、101kPa下:
①2Na(s)+
O2(g)═Na2O(s)△H=-414kJ?mol-1,
②2Na(s)+O2(g)═Na2O2(s)△H=-511kJ?mol-1,
①×2-②可得:
Na2O2(s)+2Na(s)═2Na2O(s)△H=-317kJ?mol-1,
故D正确;
故选:D.
B、由钠原子守恒可知,①和②生成等物质的量的产物时,钠元素的化合价都是由0升高到+1价,则转移的电子数相同,故B错误;
C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O2,且速率逐渐加快,故C错误;
D、热化学方程式25℃、101kPa下:
①2Na(s)+
| 1 |
| 2 |
②2Na(s)+O2(g)═Na2O2(s)△H=-511kJ?mol-1,
①×2-②可得:
Na2O2(s)+2Na(s)═2Na2O(s)△H=-317kJ?mol-1,
故D正确;
故选:D.
点评:本题是一综合题,考查化学键类型、氧化还原反应的计算、元素化合物知识、以及盖斯定律,考查了多个考点,设点全面,但难度适中,是一好题.

练习册系列答案
相关题目
 (2012?长沙模拟)X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电子数是电子层数的3倍.下列说法中不正确的是( )
(2012?长沙模拟)X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电子数是电子层数的3倍.下列说法中不正确的是( )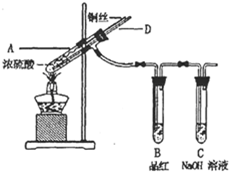 (2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.
(2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.