题目内容
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为 ,其中心原子采取 杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物
质,该反应的离子方程式为 。
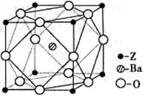
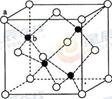
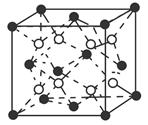
(5)Z原子基态时的外围电子排布式为 ;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶 体中氧原子与钡原子的最近距离为 cm。(只要求列算式, 不必计算出数值。阿伏伽德罗常数为NA)
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为 ,其中心原子采取 杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物
质,该反应的离子方程式为 。
(5)Z原子基态时的外围电子排布式为 ;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶 体中氧原子与钡原子的最近距离为 cm。(只要求列算式, 不必计算出数值。阿伏伽德罗常数为NA)

(1)平面三角形 sp2 分子晶体
(2)C < O < N
(3)N2O
(4)2CNO + 2H
+ 2H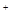 + 3ClO
+ 3ClO = N2↑ + 2CO2↑ + 3C1
= N2↑ + 2CO2↑ + 3C1 + H2O
+ H2O
(5)3d24s2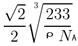
(2)C < O < N
(3)N2O
(4)2CNO
 + 2H
+ 2H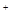 + 3ClO
+ 3ClO = N2↑ + 2CO2↑ + 3C1
= N2↑ + 2CO2↑ + 3C1 + H2O
+ H2O(5)3d24s2
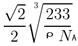
试题分析:根据①可知Q为H元素;根据②可知R 的核外电子排布式为1S22S22P2; 则R为C元素;根据③可知Y的核外电子排布式为1S22S22P4; 则Y为O元素;因为原子序数X的大于6小于8 ,所以X为N元素。④氩为18号元素,Z4+离子和氩原子的核外电子排布相同。则Z为22号Ti元素. (1)化合物M是甲醛HCHO,其空间构型为平面三角形,其中的C原子与2个H原子形成δ键,与O原子形成了1个δ键,1个Π键。所以C的杂化方式为sp2。化合物N由C、H按照1:1个数比组成的有机溶剂,则N为苯(C6H6).它是由分子构成的物质,在固态时是分子晶体。(2)C、N、O是同一周期的元素,因为N元素的原子最外层电子处于半充满的稳定状态,难失去电子,第一电离能比较大。原子序数越大,原子半径就越小,失去电子越来越难,所以电离能逐渐增大。但是由于N原子的核外电子电子处于半充满的稳定状态,所以电离能比O还大。O比C原子半径小,难失去电子。因此它们的第一电离能大小关系为C<O<N。因此这三种元素的第一电离能的大小关系是: C < O < N . (3)等电子体是原子数相同。电子数的物质。RY2为CO2,则由上述一种或多种元素组成的与CO2互为等电子体的分子N2O。(4)根据题意可知离子方程式为:2CNO-+2H++3ClO-=N2+2CO2+3Cl-+H2O。(5)Ti的核外电子排布式是1s22s22p63s23p63d24s2. 所以其基态时的外围电子排布式为3d24s2。晶胞中含有的各元素的原子个数为:Ba :1;Ti:8×1/8="1;" O:12×1/4=3.所以晶体的化学式为BaTiO3.由晶胞的结构示意图可知:Ba原子与O的最近距离为面对角线的一半。假如晶胞的边长为acm,则
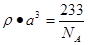 ;
; ;所以
;所以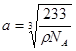 ;因此Ba原子与O的最近距离为
;因此Ba原子与O的最近距离为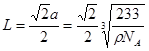 。
。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 2CuCl↓+4H++SO42-
2CuCl↓+4H++SO42-