题目内容
(14分)二甲醚(CH3OCH3)和甲醇(CH3OH)都是高效清洁能源。工业上利用煤的气化产物(水煤气)合成甲醇和二甲醚。回答下列问题:
(1)制备二甲醚最后一步反应由Al2O3催化甲醇脱水合成,反应方程式为 。
(2)已知:CO(g)+2H2(g)=CH3OH (g) △H= —90.1kJ·mol-1 CO(g)的燃烧热是282.8 kJ·mol-1;H2的燃烧热是285.8 kJ·mol-1写出表示CH3OH (g) 燃烧热的热化学反应方程式 。
(3)二甲醚直接燃料电池比甲醇直接燃料电池更高效,等质量的二甲醚和甲醇完全放电转移电子的物质的量之比是 。用二甲醚直接燃料电池电解足量饱和食盐水,当消耗9.2g二甲醚时理论上阴极产生的气体的体积为 L。(标况下)
(4)在合成中伴有水煤气交换反应:CO(g)+H2O(g)  CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
温度 | 260℃ | 280℃ | 295℃ | 310℃ |
CO转化率 | 89% | 80% | 75% | 60% |
①请解释CO转化率随温度变化的关系 。
②列式计算280℃时平衡常数 。
③若平衡体系中,测得H2的压强占总压的30%,要使体系中CO转化率达到70%,应该使温度 (填“升高”、“降低”、“不变”)
(1) 2CH3OH 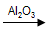 CH3OCH3 +H2O
CH3OCH3 +H2O
(2) CH3OH (g) + 3/2O2 (g) = CO2 (g) +2H2O (l);△H= -764.3KJ /mol
(3) 32/23,26.88L
(4) ①△H<0,升高温度,平衡逆向移动,CO的转化率降低。②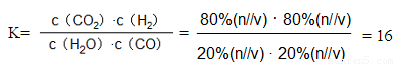 ; ③降低
; ③降低
【解析】
试题分析:(1)由甲醇制备二甲醚的方程式为:2CH3OH 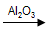 CH3OCH3 +H2O;(2) 根据题意可得热化学方程式为①CO(g)+1/2 O2 (g) = CO2 (g); △H= -282.5KJ /mol-②H2(g)+1/2 O2 (g) = H2O(l); △H= -285.8KJ /mol。①+2×②,整理可得CH3OH (g) + 3/2O2 (g) = CO2 (g) +2H2O (l);△H= -764.3KJ /mol;(3)每1mol的二甲醚(CH3OCH3)燃烧会转移电子的物质的量为12mol;1mol的甲醇反应会转移电子6mol;而所以当二者的质量相等时转移的电子的物质的量(12÷46):(6÷32)=32:23。(CH3OCH3)=9.2g÷46g/mol=0.2mol。每1mol的二甲醚(CH3OCH3反应会转移电子的物质的量为12mol,所以转移电子的物质的量为12mol×0.2=2.4mol,则在电解足量饱和食盐水的阴极产生的氢气的标况下体积为(2.4÷2)mol×22.4L/mol=26.88L; (4)①由于CO(g)+H2O(g)
CH3OCH3 +H2O;(2) 根据题意可得热化学方程式为①CO(g)+1/2 O2 (g) = CO2 (g); △H= -282.5KJ /mol-②H2(g)+1/2 O2 (g) = H2O(l); △H= -285.8KJ /mol。①+2×②,整理可得CH3OH (g) + 3/2O2 (g) = CO2 (g) +2H2O (l);△H= -764.3KJ /mol;(3)每1mol的二甲醚(CH3OCH3)燃烧会转移电子的物质的量为12mol;1mol的甲醇反应会转移电子6mol;而所以当二者的质量相等时转移的电子的物质的量(12÷46):(6÷32)=32:23。(CH3OCH3)=9.2g÷46g/mol=0.2mol。每1mol的二甲醚(CH3OCH3反应会转移电子的物质的量为12mol,所以转移电子的物质的量为12mol×0.2=2.4mol,则在电解足量饱和食盐水的阴极产生的氢气的标况下体积为(2.4÷2)mol×22.4L/mol=26.88L; (4)①由于CO(g)+H2O(g)  CO2(g)+H2(g)的正反应是放热反应,所以温度升高,化学平衡向逆反应方向移动,所以CO转化率降低。②280℃时平衡常数K为
CO2(g)+H2(g)的正反应是放热反应,所以温度升高,化学平衡向逆反应方向移动,所以CO转化率降低。②280℃时平衡常数K为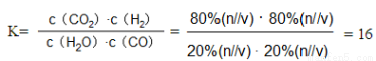 。③若平衡体系中,测得H2的压强占总压的30%,要使体系中CO转化率达到70%,应该使平衡正向移动。由于该反应的正反应是放热反应,所以温度应该降低。
。③若平衡体系中,测得H2的压强占总压的30%,要使体系中CO转化率达到70%,应该使平衡正向移动。由于该反应的正反应是放热反应,所以温度应该降低。
考点:考查化学方程式、热化学方程式的书写、物质的能量转化率的比较、化学平衡常数、外界条件对化学平衡移动的影响的知识。

 名校课堂系列答案
名校课堂系列答案短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,
R |
| ||
T | Q |
| W |
其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性